
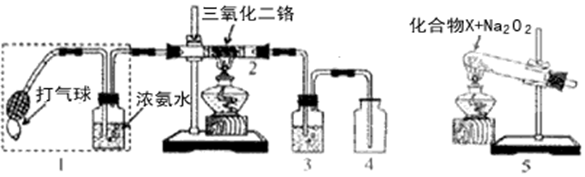
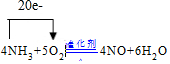 .
.分析 (1)氨催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气中的氮由-3价变成+2价,1mol转移5mol的电子,所以4mol转移20mol的电子;
(2)停止加热后仍能保持红热,该反应是放热热反应;
(3)红棕色气体为NO2,易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸,进而与氨气生成硝酸铵;
(4)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,但装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气.
解答 解:(1)氨催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气中的氮由-3价变成+2价,1mol转移5mol的电子,所以4mol转移20mol的电子,则电子转移的方向和数目为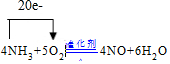 ,故答案为:
,故答案为: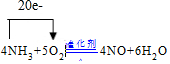 ;
;
(2)停止加热后仍能保持红热,该反应是放热热反应,故答案为:放热;
(3)NO2易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸而观察不到颜色,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3,可观察到白烟生成,
故答案为:浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3;
(4)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,但装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气,反应为:NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$HCl+NH3,2HCl+Na2O2═2NaCl+O2+H2O,故答案为:1; NH4Cl;与HCl反应生成氧气.
点评 本题考查氨气的制取原理、反应装置及化学性质,题目较为综合,涉及氨气的制取、性质以及二氧化氮和硝酸铵等知识,注意把握元素化合物知识的理解和应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 加水未达到容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为Fe3+具有氧化性,所以可以用KSCN溶液检验Fe3+ | |
| B. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | FeCl2溶液蒸干灼烧后得到FeCl2固体 | |
| D. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径:X>Y,离子半径:X3+>Y2- | |
| C. | 同族元素中Y的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com