
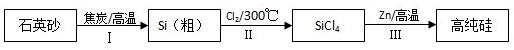
分析 (1)硅是14号元素在周期表中处于第三周期,第ⅣA族元素,二氧化硅与碱反应生成盐与水,所以是酸性氧化物;
(2)①依据碳与二氧化硅反应中元素化合价变化判断;根据SiCl4遇水剧烈水解生成SiO2和一种酸信息,反应物是SiCl4和水,生成物为二氧化硅,根据氧原子守恒,水分子前的系数为2,根据氢原子和氯原子守恒,另一产物为氯化氢;
②根据石英砂和硅之间关系式计算.
解答 解:(1)硅是14号元素在周期表中处于第三周期,第ⅣA族元素,二氧化硅与碱反应生成盐与水,所以是酸性氧化物,故答案为:第三周期,第ⅣA族;酸性;
(2)①碳与二氧化硅反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,碳元素在反应中化合价升高,发生氧化反应,碳做还原剂;根据SiCl4遇水剧烈水解生成SiO2和一种酸信息,反应物是SiCl4和水,生成物为二氧化硅,根据氧原子守恒,水分子前的系数为2,根据氢原子和氯原子守恒,另一产物为氯化氢,氯化氢前的系数为4,据此即可写出化学反应方程式SiCl4+2H2O═SiO2+4HCl,故答案为:还原剂;SiCl4+2H2O═SiO2+4HCl;
②由反应原理可知,则:
SiO 2~Si~SiCl 4~Si(纯)~2Zn
60 2×65
100t×70%×(1-10%)×80% m
所以:$\frac{60}{100t×70%×(1-10%)×80%}$=$\frac{2×65}{m}$,解得m=109.2,故答案为:109.2.
点评 本题考查了硅及其化合物的性质、化学反应方程式的书写及相关计算,掌握硅及其化合物的性质是解答的关键,难度中等.


科目:高中化学 来源: 题型:解答题
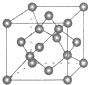 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com