
| A. | CO2 | B. | C2H6 | C. | NaOH | D. | H2O |
科目:高中化学 来源: 题型:选择题
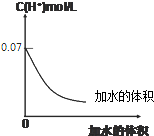
| A. | 若使溶液的pH升高1,可提高溶液的温度加水的体积 | |
| B. | 若使溶液的pH升高1,将溶液稀释到原体积的10倍 | |
| C. | 0.1 mol•L-1HIO3溶液稀释10倍后,溶液中c(H+)>c(IO3-)>c(HIO3) | |
| D. | 加水稀释过程中n(HIO3)+n((IO3-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50g 98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4L气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
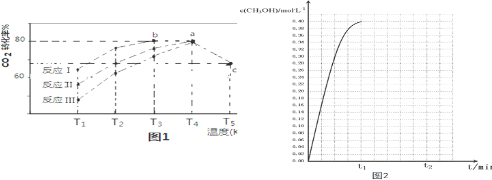
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com