
| 金属或非金属 | 钠 | 铝 | 铁 | 硅 | 硫 |
| 熔点/℃ | 97.8 | 660.4 | 1535 | 1410 | 112.8 |
| 沸点/℃ | 883 | 2467 | 2750 | 2353 | 444.6 |
| A. | 铝与硅 | B. | 铝与硫 | C. | 钠与硫 | D. | 钠与硅 |
分析 由合金的形成可知,两种金属或金属和非金属若能够形成合金,则熔点较高的金属的熔点不能大于熔点较低的金属或非金属的沸点.
解答 解:合金是不同种金属或非金属在熔化状态下形成的一种熔合物,即两种金属都成为液态时进行混合;
A.硅的熔点低于铝的沸点,两种金属能够形成合金,故A正确;
B.铝的熔点高于硫的沸点,两种金属不能够形成合金,故B错误;
C.硫的熔点大于钠的沸点,无法完成液态时混合,故钠和硫不能形成合金,故C错误;
D.硅的熔点大于钠的沸点,硅熔融后钠变化为气体,两种金属不能够形成合金,故D错误;
故选A.
点评 本题考查了合金的形成条件,题目难度不大,注意制造合金时,两种金属必须都是液态才能制成合金,一种液态、一种气态不会转化成合金.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (4)(5) | C. | (1)(2)(5) | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
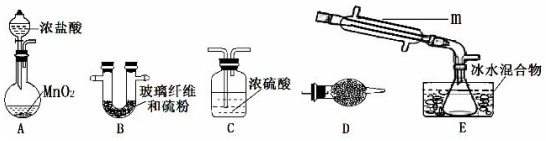
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:填空题
(一)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是 (填序号),写出反应⑥的化学方程式__ 。
(二)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)丙烯是石化工业的主要原料之一,由于市场对丙烯的需求量激增,丙烷脱氢制丙烯的技术日益受到重视。某研究机构需得到C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但直接测定实验难进行,可通过下图中各组物质能量总和及相互间 转化中的能量变化计算得到:
转化中的能量变化计算得到:

①判断:ΔH________0(选填“>”、“<”或“=”)。
②ΔH=___________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生 成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)
成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的反应的热化学方程式: _ _ _。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:○-X,●-Y,⊕-Z)
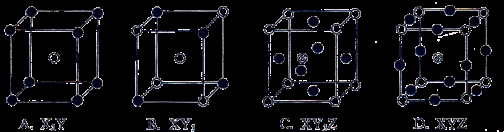
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com