
分析 若溶液中铝元素为铝离子,由Al元素守恒可知氢氧化铝的物质的量,若溶液中Al元素以AlO2-形式存在,根据由Al元素守恒可知AlO2-的物质的量,先判断溶液中的铝元素存在形式,再根据离子守恒计算即可.
解答 解:若取某浓度的NaOH溶液50.0mL与70.0mL 2.00mol•L-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,若溶液中铝元素为铝离子,由Al元素守恒可知,氢氧化铝的物质的量为:0.07L×2mol/L×$\frac{1}{2}$=0.07mol,根据氢氧根离子守恒,n(NaOH)=3n[Al(OH)3]=0.07mol×3=0.21mol,故NaOH的物质的量浓度为:$\frac{0.21mol}{0.05L}$=4.2mol/L;
若溶液中Al元素以AlO2-形式存在,根据由Al元素守恒可知,AlO2-的物质的量为:0.07L×2mol/L×$\frac{1}{2}$=0.07mol,溶液为NaCl、NaAlO2混合溶液,根据钠离子、离子守恒可知:n(NaOH)=n(NaCl)+n(NaAlO2)=3n(AlCl3)+n(NaAlO2)=3×0.07mol×2mol/L+0.07mol=0.49mol,故NaOH的浓度为:$\frac{0.49mol}{0.05L}$=9.8mol/L,
故答案为:4.2或9.8.
点评 本题考查了化学计算,难度不大,明确发生反应实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢键 分子间作用力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 分子间作用力 | D. | 分子间作用力 氢键 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
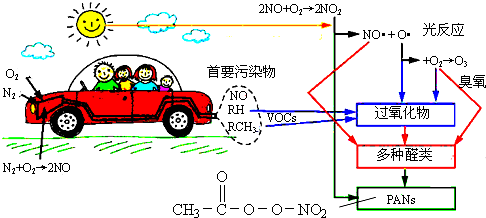
| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖属于有机高分子化合物 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用高纯硅可以制成光电池,将光能直接转化为电能 | |
| B. | CO、CO2均易于血红蛋白结合而中毒 | |
| C. | SiO2可用于制造光导纤维和半导体 | |
| D. | SiO2和H2O反应可直接制备H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
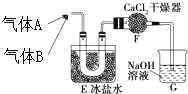 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.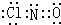 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| B. | 自然界中硅的储量丰富,仅次于氧,自然界中存在大量的单质硅 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),不涉及氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com