
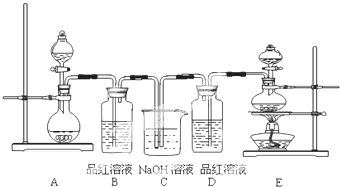
| ||


科目:高中化学 来源: 题型:
| 实验编号 | 待测液体积 (mL) | 酸性KMnO4体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 1 | 20.00 | 0.10 | 16.58 |
| 2 | 20.00 | 0.00 | 15.98 |
| 3 | 20.00 | 0.10 | 16.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、此反应的平衡常数K=
| ||
| B、改变条件该反应的平衡常数K一定不变 | ||
| C、改变压强并加入催化剂,平衡常数会随之变化 | ||
| D、平衡时增大A和B的浓度,平衡常数会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH<7 |
| B、混合溶液中:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)] |
| D、混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol?L-1KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com