
����Ŀ��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1����25�桢101kPa�£�1g�״���CH3OH��ȼ������CO2��Һ̬ˮʱ����22.68kJ�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ___��
��2��25�桢101kPa��������N2��O2��ȫ��Ӧ��ÿ����23gNO2��Ҫ����16.95kJ����___��
��3��25�桢101kPa��֪��1mol H��H����1molN��H����1molN��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ___��
��4���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H2
CH3OH��g��+H2O(g) ��H2
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
�ش��������⣺
��֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C | H��O | C��H |
E/��kJ��mol-1�� | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=___kJ��mol-1����֪��H2=-58kJ��mol-1������H3=___kJ��mol-1��
���𰸡�CH3OH(l)+3/2O2(g)�TCO2(g)+2H2O��l�� ��H=��725.76kJmol��1 N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJmol��1 N2(g)+3H2(g)=2NH3(g) ��H=-92kJmol��1 -99 +41
��������
���ʵ��������������ȣ��ʱ���ڶ��ѻ�ѧ�����յ�������ȥ�ɼ��ͷŵ�������������ʵ�״̬���ʱ�����д�Ȼ�ѧ����ʽ���ݴ˷����ڣ�1������2������3���ʣ���Ӧ��=��Ӧ���ܼ����������ܼ��ܣ���ϸ�˹���ɽ������ڣ�4���ʡ�
��1��1gҺ̬�״�(CH3OH)ȼ������CO2��Һ̬ˮʱ����22.68 kJ����֪1molҺ̬�״�(CH3OH)ȼ������CO2��Һ̬ˮʱ����22.68kJ��32=725.76kJ����״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)+3/2O2(g)�TCO2(g)+2H2O(l) ��H=��725.76kJmol��1��
��2��������N2��O2��ȫ��Ӧ��ÿ����23gNO2��Ҫ����16.95kJ������2mol����������Ӧ�ų�����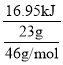
![]() 2=67.8 kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJmol��1��
2=67.8 kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJmol��1��
��3����ѧ��Ӧ���ʱ���ڷ�Ӧ��ļ���֮�ͼ�ȥ������ļ���֮�ͣ���N2(g)+3H2(g)=2NH3(g) ��H����946 kJ��mol��1+3��436 kJ��mol��1-6��391 kJ��mol��1��=��92 kJ��mol��1��
��4����H1=1076 kJ��mol-1+2��436 kJ��mol-1(3��413+343+465) kJ��mol-1=99 kJ��mol-1��
���ݸ�˹���ɣ�����=�ۣ�����H3=��H2��H1=58 kJ��mol-1(99 kJ��mol-1)=+41 kJ��mol-1��
�ʴ�Ϊ��99��+41��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Ӧ��2A![]() B��D�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ��(mol��L��1)�淴Ӧʱ��(min)�ı仯������±���
B��D�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ��(mol��L��1)�淴Ӧʱ��(min)�ı仯������±���
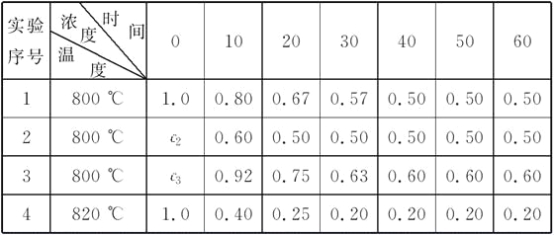
�����������ݣ����������գ�
(1)��ʵ��1�У���Ӧ��10��20 minʱ����A��ƽ������Ϊ________mol��L��1��min��1��
(2)��ʵ��2�У�A�ij�ʼŨ��c2��__________mol��L��1����Ӧ��20 min�ʹﵽƽ�⣬���Ʋ�ʵ��2�л�������������
________________________________________________________________________��
(3)��ʵ��3�ķ�Ӧ����Ϊv3��ʵ��1�ķ�Ӧ����Ϊv1����v3________v1(������������������������)����c3________1.0 mol��L��1(������������������������)��
(4)�Ƚ�ʵ��4��ʵ��1�����Ʋ�÷�Ӧ��________��Ӧ(ѡ��������������������)��������
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�Na2FeO4���Ǿ�����ɫ����ķ�ĩ����һ�ָ�Ч��ɫǿ�������������������ȶ��������ڷ�ˮ��������ˮ�Ĵ�����ʵ������ʯī������Ϊ�缫���Բ�ͬŨ�ȵ�NaOH��ҺΪ�������Һ������һ����ѹ����Ʊ��������ƣ����װ�ú�����������
c(NaOH) | �������� | �������� |
1 mol��L��1 | ������ɫ���� | ������ɫ���壬10min����Һ��ɫ�����Ա仯 |
10 mol��L��1 | ����������ɫ���� | ����������ɫ���壬3min����Һ��Ϊdz�Ϻ�ɫ��������� |
15 mol��L��1 | ����������ɫ���� | ����������ɫ���壬1min����Һ��Ϊdz�Ϻ�ɫ��������� |
����˵������ȷ����

A. aΪ������bΪʯī
B. ������Ҫ������Ӧ��2H2O + 2e��=== H2��+ 2OH��
C. ��Ũ�ȵ�NaOH��Һ�������ڷ���Fe��6e��+ 8OH��=== FeO42��+ 4H2O
D. �Ʊ�Na2FeO4ʱ�����ñ���NaCl��Һ������Ч����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������п��a��b���ֱ������֧��ͬ���Թ��У�Ȼ��������������ʵ���Ũ���Ҿ�������ϡ���ᣬͬʱ��a�м�������CuSO4��Һ����������������(V)��ʱ��(t)�Ĺ�ϵ��ͼ���ʾ���£�������ȷ����(����)
A. 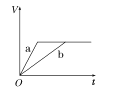 B.
B. 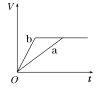 C.
C. 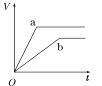 D.
D. 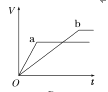
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧԺ�����Ŷ��о����֣��ڳ��³�ѹ�Ϳɼ����£�����LDH��һ�ֹ���������ϳ�NH3��ԭ��ʾ��ͼ���¡�����˵������ȷ���ǣ�������
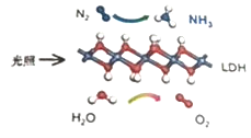
A.�ù��̽�̫����ת����Ϊ��ѧ��
B.�ù����У�ֻ�漰�����Լ��Ķ���������
C.�������뻹ԭ�������ʵ���֮��Ϊ1��3
D.ԭ����N2��ͨ������Һ̬�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ǧ���طŵ�ʱ��ط�ӦΪPbO2��Pb��4H����![]() =2PbSO4��2H2O����ͼ��Ǧ���صĹ���ԭ��ʾ��ͼ������˵����ȷ����
=2PbSO4��2H2O����ͼ��Ǧ���صĹ���ԭ��ʾ��ͼ������˵����ȷ����
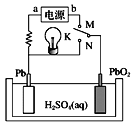
A.K��N����ʱ����װ���е���ת��Ϊ��ѧ��
B.K��N����ʱ��H+���ƶ�
C.K��M����ʱ��aΪ��Դ�ĸ���
D.K��M����ʱ������������Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС����̽������ɫ����������ˮ��Ӧ�Ƿų�����������������ʱ�������ͼ��ʾ��ʵ��װ�á�

��С�Թ������1g����ɫ�������ƣ���С�Թ����ڴ�֧�ܵ��Թ��ڡ���U�ι��ڼ���������īˮ����T�ι������У�ʹU�ι������ߵ�Һ�洦��ͬһˮƽ�档�ټн������У���ˮ����С�Թ��ڣ��ɹ۲쵽U�ι��Ҳ��Һ�������½�������Һ��������
��1���������Ƶĵ���ʽ__��
��2��д��������Ӧ�Ļ�ѧ����ʽ__��
��3�����и�ͼ�У���ʾ����������ˮ��Ӧ��ͼ����_______��
A.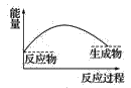 B.
B.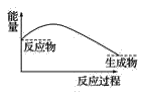
C.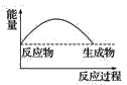 D.
D.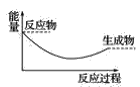
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������������װ�á�
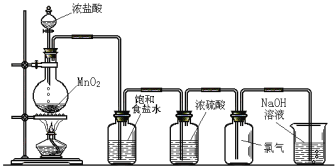
Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________������1��Cl2����ת�Ƶ�����ĿΪ________��������ʳ��ˮ��������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ���������ʵ��װ����ͼ��ʾ(�г�װ������ȥ)������˵��������ǣ� ��
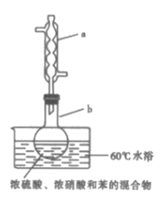
A.ˮԡ���ȵ��ŵ�Ϊʹ��Ӧ�����Ⱦ��ȡ��������¶�
B.Ũ���ᡢŨ����ͱ����ʱ��Ӧ����Ũ�����л�������Ũ���ᣬ����ȴ�����º��ٽ�����ε���
C.����a���������������������ԭ�ϵ�������
D.��������a��b����Ӧ��Ļ����ֱ������õ���Ʒ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com