
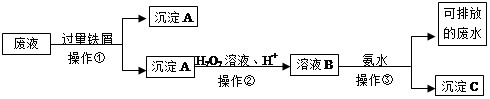
 NH3?H2O
NH3?H2O NH4++OH-,溶液B中加氨水,发生Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
NH4++OH-,溶液B中加氨水,发生Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
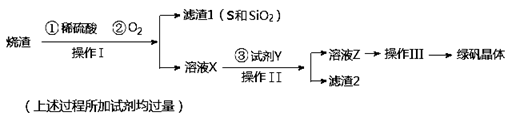
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
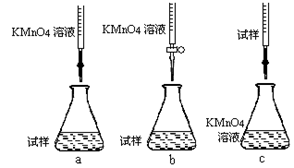
科目:高中化学 来源:不详 题型:单选题
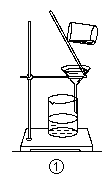
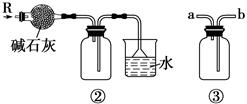
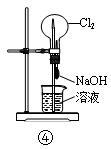
| A.装置①可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
| B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集NO2气体 |
| D.装置④可用于证明Cl2易与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 药品 | 操作 |
| A | 溴水 | NaCl | 酒精 | 萃取 |
| B | 乙醇 | 醋酸 | NaOH | 过滤 |
| C | Na2CO3 | NaHCO3 | H2O | 溶解、过滤 |
| D | Fe | Al | NaOH溶液 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 | 结论 |
| A. | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B. | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C. | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D. | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质 | 杂质 | 所用试剂 | 分离方法 |
| A. | KCl | CaCl2 | Na2CO3溶液、盐酸 | 过滤 |
| B. | CH3CH2OH | CH3COOH | CaO | 蒸馏 |
| C. | NaCl | NH4Cl | NaOH | 蒸干 |
| D. | N2 | O2 | 铜网 | 加热 |
查看答案和解析>>
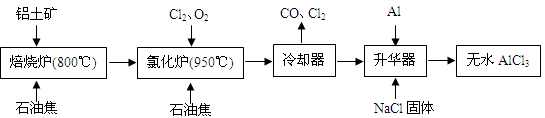
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com