
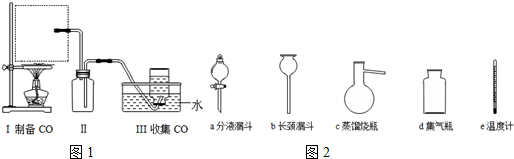
分析 (1)①该制备原理符合:液体+液体$\stackrel{△}{→}$气体,且需控制反应的温度,用分液漏斗添加甲酸,在蒸馏烧瓶中反应;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用;
(2)①研磨使CuSO4•5H2O晶体和NaHCO3固体混合均匀;
②温度过高,碱式碳酸铜会分解生成CuO;
③碱式碳酸铜表面会附着硫酸根离子,用氯化钡溶液检验最后一次洗涤液中是否含有硫酸根离子判断;
④甲酸铜的溶解度随温度的升高而变大,需趁热过滤;
⑤甲酸铜易溶于水,难溶于有机溶剂,洗去晶体表面的水和其它杂质,减少甲酸铜晶体的损失;
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性.
解答 解:(1)①该制备原理符合:液体+液体$\stackrel{△}{→}$气体,用分液漏斗添加甲酸,在蒸馏烧瓶中反应,且需控制反应的温度,温度计水银球应在液面以下,但不能接触烧瓶底部,
故答案为:ac;液面以下,但不能接触烧瓶底部;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用,防止水因倒吸而流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
(2)①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是:研细并混合均匀,使反应充分,
故答案为:研细并混合均匀;
②温度过高,碱式碳酸铜会分解生成黑色的CuO,
故答案为:出现黑色固体;
③碱式碳酸铜表面会附着硫酸根离子,检验洗涤干净方法:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净,
故答案为:滴加BaCl2溶液;
④甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,防止甲酸铜晶体析出,
故答案为:防止甲酸铜晶体析出;
⑤甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的水及其它杂质,减少甲酸铜晶体的损失,
故答案为:洗去晶体表面的水和其它杂质,并减少甲酸铜晶体的损失;
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性,具体实验方案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,
故答案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,则说明甲酸具有较强的还原性.
点评 本题考查物质制备实验,涉及对装置与操作的分析评价、基本操作、实验方案设计等,是对化学实验综合考查,注意掌握物质制备方案的设计原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
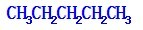 ;
;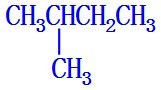 ;
;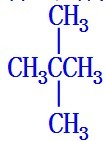 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
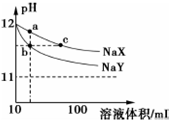 常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )| A. | 相同温度下,电离平衡常K(HX)<K(HY) | |
| B. | b、c两点溶液中水的电离程度相同 | |
| C. | a点溶液中:c(H+)+c(HX)=c(OH-) | |
| D. | b、c两点溶液中Na+的物质的量:nb(Na+)<nc(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M一定是第VIA族元素 | B. | M的最高价氧化物为RO2 | ||
| C. | M的气态氢化物一定能形成氢键 | D. | M的气态氢化物溶于水可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | |
| B. | Tl(OH)3 和Al(OH)3一样都属于两性氢氧化物 | |
| C. | 硫化氢比硒化氢稳定 | |
| D. | 锂与氧气在点燃的条件下生成氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于90% | B. | 等于90% | C. | 大于90% | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com