

| A. | 点e的正反应速率比点d的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不同 | |
| D. | 在给定条件下,t1、t2时刻NH3的含量相同 |
分析 A.e、d处于同一平衡状态;
B.c后氨气物质的量增大到不变,氢气物质的量减小到不变,则c点反应向正反应进行;
C.e、d两点处于同一平衡状态;
D.在给定条件下,t1、t2时刻处于同一平衡状态.
解答 解:A.e、d处于同一平衡状态,正反应速率相等,故A错误;
B.c后氨气物质的量增大到不变,氢气物质的量减小到不变,c点未到达平衡状态,反应向正反应进行,故B错误;
C.e、d两点处于同一平衡状态,n(N2)相同,故C错误;
D.在给定条件下,t1、t2时刻处于同一平衡状态,NH3的含量相同,故D正确,
故选:D.
点评 本题考查化学平衡图象、平衡状态建立,难度不大,注意理解化学平衡状态的特征.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液和FeCl3溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | CuSO4溶液和Ba(OH)2溶液 | D. | Na2SO4溶液和MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
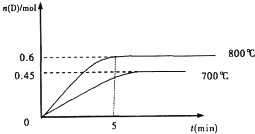 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com