
根据氢元素最高正价与最低负价的绝对值相等,有人提议可把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在________族.
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
 (1)根据氢元素最高正价与最低负价的绝对值相等,有人提议可把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在
(1)根据氢元素最高正价与最低负价的绝对值相等,有人提议可把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在查看答案和解析>>
科目:高中化学 来源: 题型:
(2)某元素X的核外电子数等于核内中子数,取该元素单质
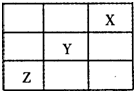
(3)短周期元素X、Y、Z在周期表中的位置关系如下图所示,则:

①Y、Z元素的气态氢化物的稳定性_______________>_______________。(填化学式)
②与Y元素同主族且相邻的元素的单质与NaOH溶液反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有人认为处于第IA族的氢元素也可以放在其他主族中,下列有关说法不正确的是
A、根据氢元素再得一个电子形成稳定结构可以放在第 ⅦA族
B、根据氢元素可与碱金属元素形成离子化合物NaH,可以放在 ⅦA族
C、氢元素应放在氟元素的上边
D、根据氢元素最高正价与最低负价的绝对值相等可以放在ⅣA族
查看答案和解析>>
科目:高中化学 来源:2006-2007学年山东省潍坊市高一(下)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
下面是元素周期表的简略框架图。

(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。按电子排布,可把元素划分成5个区,(s区,p区,d区,ds区,f区)不全是金属元素的区为__________。
(2)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的___________族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实
(3)上表中元素x、y原子的最外层电子的电子排布式分别为 、 ;比较元素x与元素y的下列性质(填写“>”或“<”=)
原子半径:x_______y、电负性:x_______y、金属性:x_______y。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com