
| A. | 第一步 | B. | 第二步 | C. | 第三步 | D. | 第四步 |
科目:高中化学 来源: 题型:选择题
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
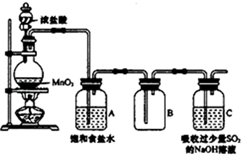 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )| A. | ① | B. | ①③ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{32}$ mol-1 | B. | 16m mol-1 | C. | m mol-1 | D. | 32m mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C (s)+O2(g)=CO (g)△H=-110.5 kJ/mol | |
| B. | C (s)+O 2(g)=CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
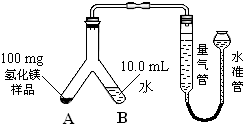
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com