
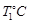 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);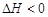 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。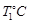 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
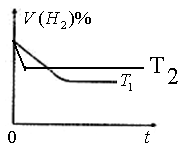
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)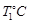 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在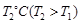 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。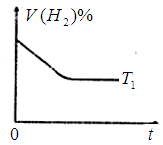
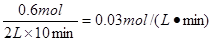 。氮气的转化率为
。氮气的转化率为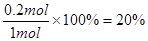 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g),下列有关说法不正确的是( )
2NH3(g),下列有关说法不正确的是( )| A.达到平衡时,正反应速率等于逆反应速率 | B.增大氢气的浓度可增大反应速率 |
| C.在上述条件下,氢气能全部转化为氨气 | D.达到平衡时,体系中各物质的浓度不再改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制FeSO4溶液时在溶液中加入稀硫酸 |
| B.温度控制在450℃有利于二氧化硫的催化氧化 |
| C.增大压强有利于合成氨反应 |
D.工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
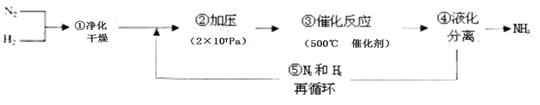
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3,下列有关叙述正确的是
2NH3,下列有关叙述正确的是| A.N2和NH3的质量分数相等 | B.N2、H2、NH3的浓度之比为1:3:2 |
| C.反应物和生成物浓度不再发生变化 | D.正反应和逆反应不再进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g) 此反应达到平衡的标志是( )
2Z(g) 此反应达到平衡的标志是( )| A.正反应和逆反应的速率都为零 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1molX同时生成0.2molZ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%, 此时,再向密闭容器中加入1mol PCl5 ,充分反应,再次平衡后,下列有关说法正确的是( )
PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%, 此时,再向密闭容器中加入1mol PCl5 ,充分反应,再次平衡后,下列有关说法正确的是( )| A.PCl5的分解率大于a% |
| B.PCl5的分解率小于a% |
| C.达到平衡后正逆反应速率比原平衡状态时大 |
| D.达到平衡后正逆反应速率比原平衡状态时小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 ( )
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )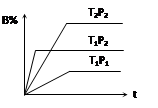
| A.T1<T2、P1>P2、m+n>p,⊿H <0; |
| B.T1>T2、P1<P2、m+n>p,⊿H >0; |
| C.T1>T2、P1<P2、m+n<p,⊿H >0; |
| D.T1<T2、P1>P2、m+n<p,⊿H <0; |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com