
| A. | 向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+ | |
| B. | 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 | |
| C. | 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
分析 A.KSCN溶液与铁离子结合,溶液为血红色;
B.高锰酸钾可氧化亚铁离子、氯离子;
C.铁离子与碱反应生成红褐色氢氧化铁沉淀;
D.加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,可知一定含亚铁离子.
解答 解:A.KSCN溶液与铁离子结合,溶液为血红色,则溶液中含Fe3+,不能确定是否含Fe2+,故A错误;
B.酸性条件下高锰酸钾可氧化亚铁离子、氯离子,则不能检验是否含FeCl2,故B错误;
C.铁离子与碱反应生成红褐色氢氧化铁沉淀,则加入NaOH溶液得红褐色沉淀,说明溶液中含有Fe3+,故C正确;
D.加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,可知一定含Fe2+,不能确定是否含Mg2+,故D错误;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、发生的反应及现象等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
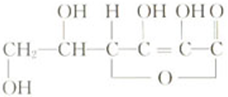 维生素C的结构式如下,
维生素C的结构式如下,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 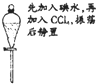 实验:液体分层,上层呈紫红色 | |
| B. |  实验:烧杯中先出现白色沉淀,后溶解 | |
| C. |  实验:试管中溶液颜色变为血红色 | |
| D. | 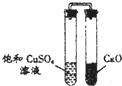 实验:放置一段时间后,饱和CuSO4溶液中出现白色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
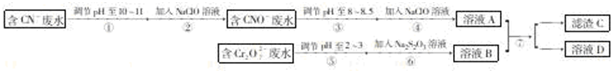
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com