
分析 根据物质的分类知识:①纯碱属于钠盐,②盐酸属于无氧酸,③稀硫酸属于含氧酸,④氯化钙溶液属于盐,⑤烧碱属于碱,⑥氧化铁属于盐,⑧氢氧化铁属于不溶性的碱,根据题目要求结合物质的性质来书写化学方程式.
解答 解:(1)无氧酸与钠盐之间的反应,如:Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)碱与无氧酸之间的反应,如:NaOH+HCl═NaCl+H2O,
故答案为:NaOH+HCl═NaCl+H2O;
(3)两种盐溶液之间的反应,如:Na2CO3+CaCl2═CaCO3+2NaCl,
故答案为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)含氧酸与不溶性碱之间的反应,如:2Fe(OH)3+3H2SO4═Fe2(SO4)3+6H2O,
故答案为:2Fe(OH)3+3H2SO4═Fe2(SO4)3+6H2O.
点评 本题考查了化学方程式的书写,物质的分类,明确物质的性质及发生的化学反应是解题关键,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
 甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将Cl2通入紫色石蕊溶液中,溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O所含有原子数为3NA | |
| B. | 1mol OH-中含电子数目为9NA | |
| C. | 标准状况下,11.2LN2和NO的混合气体所含的原子数为NA | |
| D. | 每燃烧12gC,转移的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-乙基-1,3-丁二烯的键线式: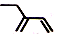 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 用溴水可鉴别苯、CCl4、苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
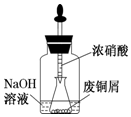 由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A和$\frac{n}{2}$molB,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A和n mol B,A、B的转化率均不变 | |
| D. | 如图表示该反应的正反应速率随时间的变化情况,t1时刻可能是减小了A的浓度,增加了C的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com