

| 1 |
| 3 |
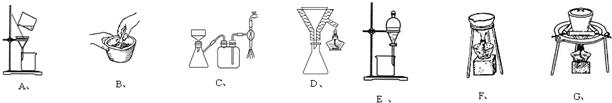
| m |
| M |
| 12.5g |
| 250g/mol |
| 9.5g |
| 84g/mol |
| 7.91g |
| 226g/mol×0.05mol |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:
原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
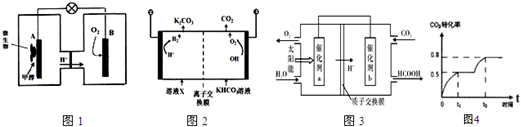
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
A、一定含有I-,一定没有NO
| ||
B、可能含有NO
| ||
C、可能含有NO
| ||
| D、一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
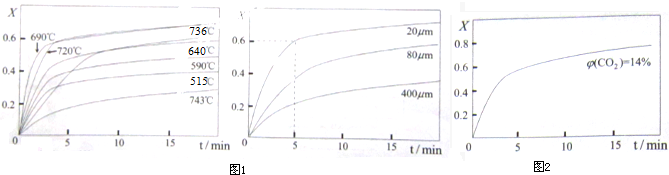
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O═2NaOH |
| B、SO2+H2O═H2SO3 |
| C、Cl2+H2O═HCl+HClO |
| D、4Li+O2═2Li2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com