
【题目】盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.铁被氧化的电极反应式为Fe3e=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.一段时间后, 右侧导管液面会下降
D.活性炭的存在会加速铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:

已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S)![]() Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。
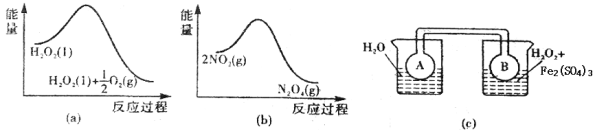
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+![]() O2(g)
O2(g)![]() H2O(g),反应过程中能量变化如图所示,请回答下列问题。
H2O(g),反应过程中能量变化如图所示,请回答下列问题。
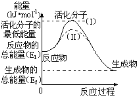
(1)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能_____,单位体积内活化分子的百分数__,因此反应速率____,(前面的三个空填“增大”“减小”“不变”)你认为最可能的原因是_______。
(2)在一固定容积的密闭容器中,进行如下反应:CsH2Og![]() COgH2g。若容积体积为2L,反应10s H2质量增加0.4g,则该时间内CO的反应速率为___。若增加炭的量,则正反应速率____(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向_____移动(选填“正向”、“逆向”或“不”)。
COgH2g。若容积体积为2L,反应10s H2质量增加0.4g,则该时间内CO的反应速率为___。若增加炭的量,则正反应速率____(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向_____移动(选填“正向”、“逆向”或“不”)。
(3)若降低温度,平衡逆向移动,则正反应是______反应(选填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列表示甲醇燃烧热的热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+725.8 kJ·mol﹣1
O2(g)=CO2(g)+2H2O(l) △H=+725.8 kJ·mol﹣1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol﹣1
C. CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ·mol﹣1
O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ·mol﹣1
D. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=+1 452 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下恒容容器中,可逆反应![]() 达到平衡状态的标志是
达到平衡状态的标志是
①单位时间内生成n mol H2的同时生成2n mol HI
②单位时间内生成n mol H2的同时,生成n molI2
③用HI、I2、H2的物质的量浓度变化表示的反应速率的比为2∶1∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的压强不再改变的状态
A.①④ .B.①④⑤ .C.①②④⑤ .D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称.甲池是 ______装置,乙池是 ______ 装置;
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ______ ,B(石墨)电极的名称是 ______ ;
(3)通入O2的电极的电极反应式为: ______ ,A (Fe)电极的电极反应式为 ______ ;
(4)乙池中反应的化学方程式为 ______ ;
(5)电解一段时间后,乙池中A(Fe)极的质量增加5.4g时,且溶液的体积为500mL,求所得溶液在25℃时的pH= ______ ,甲池中消耗O2为 ______ mL(标准状况下).
(6)钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,用电化学法制得CoFe2O4。以NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol·L-1的下列溶液的pH如下表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D. 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com