
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。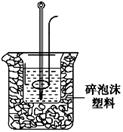
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理由是: 。在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为 次。
④若反应前溶液以及中和后的混合液的密度均设为 1 g/cm3,混合前酸与碱的温度均为t1,混合后溶液的温度为t2,比热容为 4.18 J/(g·℃)。那么该生测定中和热:ΔH= 。
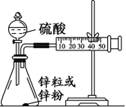
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:

图Ⅰ 图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
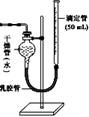
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是: 。
③该实验结果中,你估计与酸反应较快的是 。
(1)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O ΔH=-57.3 kJ/mol
(2)① 温度计、环形玻璃搅拌棒
② 未用硬纸板(或塑料板)盖住烧杯 偏低
③ 保证硫酸完全反应 3
④ kJ/mol
kJ/mol
(3)①测定相同条件下氢气的体积
②向下移动滴定管,直到两边液面相平
③锌粉
解析试题分析:(1)中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式是1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O ΔH=-57.3 kJ/mol。
(2)①由于需要测量溶液的温度以及反应还需要搅拌,所以还缺少的玻璃仪器有温度计、环形玻璃搅拌棒。
②根据装置图可知实验中没有用硬纸板(或塑料板)盖住烧杯,这样就会导致热量的损失,实验测定结果会偏低。
③氢氧化钠过量可以保证硫酸完全反应,从而减少实验误差。实验中需要测量的数据是溶液的温度,因此至少需要测量3次,即反应前酸和碱的溶液温度,以及反应后溶液的温度。
④溶液的质量是100g,反应中放出的热量是100×4.18×(t2-t1)J=0.418(t2-t1)kJ。由于反应中有0.025mol的水生成,所以中和热= kJ/mol。
kJ/mol。
(3)①要比较反应速率的大小,除了测量时间外,还需要测定相同条件下生成氢气的体积。
②由于气体的体积受温度和压强的影响,所以必须保证气体的压强和大气压是相同的,因此正确的操作是向下移动滴定管,直到两边液面相平。
③由于锌粉的表面积大,反应速率快,即反应速率较快的是锌粉。
考点:考查热化学方程式的书写、中和热的测定以及影响反应速率的因素等
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。化学实验综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求学生必须扎实的基础,并且通过进行知识的类比、迁移、重组,全面细致的思考才能正确解答。


科目:高中化学 来源: 题型:
下列有关热化学方程式的评价合理的是( )
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省衡水中学高二下学期期末考试化学试卷(带解析) 题型:填空题
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为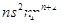 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省东莞市第七高级中学高一下学期期中考试化学试卷(带解析) 题型:单选题
已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是
| A.金刚石比石墨稳定 | B.石墨转化为金刚石是物理变化 |
| C.石墨的能量比金刚石的能量高 | D.由石墨制备金刚石一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷解析版) 题型:填空题
明矾石经处理后得到明矾【 KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
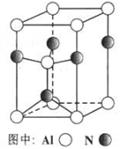
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1=
一197 kJ/mol;
2SO3(g) △H1=
一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ① 。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸 ② t。
查看答案和解析>>
科目:高中化学 来源:2014届四川省绵阳市高二12月月考化学试卷(解析版) 题型:实验题
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
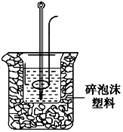
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理由是: 。在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为 次。
④若反应前溶液以及中和后的混合液的密度均设为 1 g/cm3,混合前酸与碱的温度均为 t1,混合后溶液的温度为 t2,比热容为 4.18 J/(g·℃)。那么该生测定中和热:ΔH= 。
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:
图Ⅰ 图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是: 。
③该实验结果中,你估计与酸反应较快的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com