
分析 (1)常温下,pH=11的NaOH溶液稀释1000倍后,氢氧根离子浓度减小103倍,结合离子积常数计算得到氢离子浓度增大103倍,氢氧化钠溶液无论稀释多少倍,不会变成酸溶液,其pH只能无限接近7;
(2)Ba(OH)2是一种强电解质,完全电离,1molBa(OH)2电离产生2molOH-,所以C(OH-)=C(Ba(OH)2)×2,据此解答;pH=11的Ba(OH)2溶液中氢离子都是由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH-);
(3)先根据混合溶液的氢氧根离子浓度,再结合离子积常数计算氢离子浓度,根据溶液pH的公式计算.
解答 解:(1)pH=11的NaOH溶液稀释至1000倍,氢氧根离子浓度减小103倍,结合离子积常数计算得到氢离子浓度增大103倍,溶液PH为8,稀释105倍后溶液的pH只能无限接近7,不可能小于7,
故答案为:8;无限接近7但大于7;
(2)pH=11的Ba(OH)2溶液,C(H+)=10-11mol/L,C(OH-)=$\frac{Kw}{c({H}^{+})}$=10-3mol/L,则C(Ba(OH)2)=0.5×c(OH-)=0.0005 mol•L-1=5×10-4mol/L,pH=11的Ba(OH)2溶液中氢离子由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-11mol/L,
故答案为:5×10-4;10-11;
(3)设两种碱的体积都是1L,pH=10和pH=12的两种NaOH溶液等体积混合后,混合溶液中氢氧根离子浓度=$\frac{1{0}^{-2}+1{0}^{-4}}{2}$mol/L=5.05×10-3 mol/L,则混合溶液中氢离子浓度=$\frac{1{0}^{-14}}{5.05×1{0}^{-3}}$mol/L=2×10-12mol/L,pH=11.7,
故答案为:11.7.
点评 本题考查了pH的简单计算,先计算溶液中氢离子浓度,再根据pH公式计算溶液的pH值,题目较简单.


科目:高中化学 来源: 题型:填空题
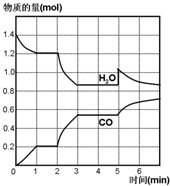 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②③①⑤ | B. | ⑤③①②④ | C. | ⑤①③②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和油脂都能与NaOH溶液反应 | |
| B. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| C. | 淀粉水解与纤维素水解得到的最终产物相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +HNO3$→_{△}^{浓盐酸}$ +HNO3$→_{△}^{浓盐酸}$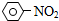 +H2O 取代反应 +H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br CH2Br; 加成反应 | |
| C. | CH3CH2OH+HCl→CH3CH2Cl+H2O; 酯化反应 | |
| D. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O; 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
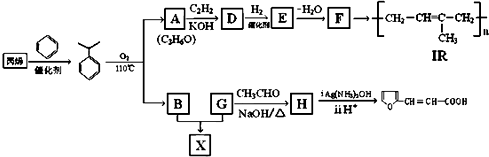
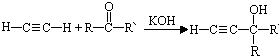
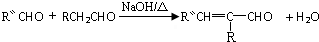
 ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.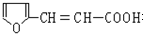 有多种同分异构体,符合下列要求的有6种.
有多种同分异构体,符合下列要求的有6种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气,则乙一定是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的己烷所含的分子数为0.5 NA | |
| B. | 28 g乙烯所含共用电子对数目为4 NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1n NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大 于吸热反应的反应速率
于吸热反应的反应速率
C.根据盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com