
| A. | $\frac{b-2c}{a}$ mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{4c-2b}{a}$ mol/L | D. | $\frac{b-4c}{a}$mol/L |
分析 bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.根据溶液不显电性,计算出每份中NO3-的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol,
令每份中NO3-的物质的量为n,根据溶液不显电性,
则:bmol×1=cmol×2+n×1,
解得:n=(b-2c)mol,
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=$\frac{(b-2c)mol}{0.5aL}$=$\frac{2b-4c}{a}$mol/L,
即原溶液中硝酸根的浓度为$\frac{2b-4c}{a}$mol/L,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,关键明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
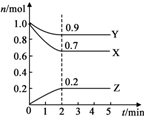 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体中无FeCl2 | B. | ③中使KMnO4褪色的是NO2- | ||
| C. | G的pH>7 | D. | 固体由Ba(OH)2?AlCl3?Na2SO3组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
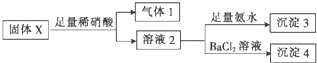
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com