
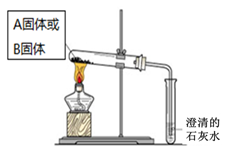
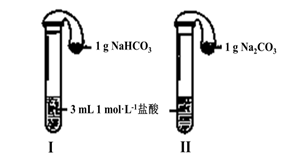
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.除④⑦外 | B.除①③外 | C.除③④外 | D.除①④外 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应产生的还原产物是一氧化氮 |
| B.反应产生的还原产物是二氧化氮 |
| C.反应产生的还原产物既有一氧化氮又有二氧化氮 |
| D.反应产生的还原产物是硝酸铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

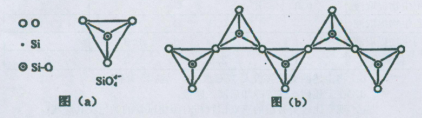
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO↑+H2O
CO↑+H2O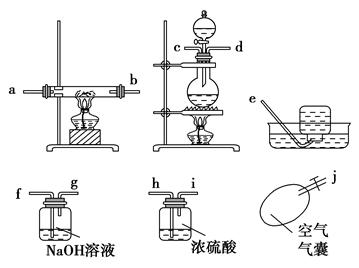
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 溶液 | 操作及现象 |
| A | CaCl2溶液 | 通入CO2,溶液不变浑浊;再通入氨气,溶液变浑浊 |
| B | Na2SiO3溶液 | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失 |
| C | Ca(ClO)2溶液 | 通入CO2,溶液变浑浊;再加入品红溶液,红色不褪去 |
| D | BaCl2溶液 | 先通入NO2,再通入SO2至过量,先生成沉淀后沉淀消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com