
下列仪器中具有①溶解固体,②配制溶液,③加热较多量液体三种用途的是( )
| A.集气瓶 | B.量筒 |
| C.试管 | D.烧杯 |
科目:高中化学 来源: 题型:单选题
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 | 未出现红色沉淀 | 葡萄糖中不含有醛基 |
| B | 向溶液X中先滴加盐酸,再滴加BaCl2溶液 | 滴加盐酸时无明显现象,滴加BaCl2溶液时出现白色沉淀 | X中一定含有SO42- |
| C | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作能使实验结果偏低的是
| A.用蒸馏水润湿的pH试纸所测定的某酸溶液的pH |
| B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度 |
| C.用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol·L-1H2SO4溶液的浓度 |
| D.用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用某仪器量一液体体积时,平视时读数为nml,仰视时读数为xml,俯视时读数为yml,若x>n>y,则所用的仪器可能是( )
| A.量筒 | B.酸式滴定管 | C.碱式滴定管 | D.容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的贮存方法,正确的是( )
| A.硅酸钠溶液和碱性溶液存放在胶塞密封的试剂瓶中 |
| B.氢氟酸盛放在棕色试剂瓶中 |
| C.液溴盛放在带有胶塞的细口瓶中 |
| D.氯水盛放在棕色细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。若某氮化铝中含有碳或氧化铝中的一种,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
(1)实验有关操作为:a.往烧瓶中放入适量的AlN样品:b.从分液漏斗往烧瓶中加入过量的浓NaOH溶液:c.检验装置的气密性;d.测定收集到水的体积。
正确的操作顺序为: 。
(2)本实验中(图Ⅰ)检查装置气密性的方法是: 。
(3)广口瓶中的试剂X可选用 (填选项前的标号)。
| A.汽油 | B.酒精 | C.植物油 | D.CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的物质的量浓度。
(1)在容量瓶的使用方法中,下列操作不正确的是(填字母)________。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液润洗 |
| C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
| D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近标线1~2 cm处,用滴管逐滴滴加蒸馏水至标线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: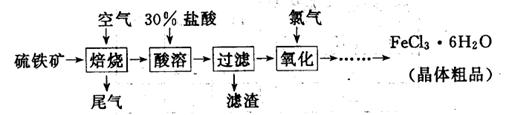
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。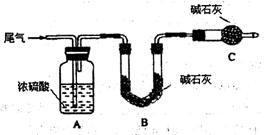
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com