
| A. | 氯化镁 | B. | 偏铝酸钠 | C. | 碳酸铵 | D. | 高锰酸钾 |
分析 A.MgCl2是强酸弱碱盐,Mg 2+易水解生成Mg(OH)2和盐酸,升高温度促进盐酸挥发,蒸干溶液得到氢氧化镁,灼烧Mg(OH)2,Mg(OH)2分解;
B.NaAlO2是强碱弱酸盐,AlO2-水解生成HAlO2和NaOH,因为HAlO2没有挥发性,所以蒸干溶液得到的固体是NaAlO2,NaAlO2受热不易分解;
C.碳酸铵受热易分解生成二氧化碳、氨气和水;
D.高锰酸钾受热易分解生成锰酸钾、二氧化锰和氧气.
解答 解:A.MgCl2是强酸弱碱盐,Mg 2+易水解生成Mg(OH)2和盐酸,升高温度促进盐酸挥发,蒸干溶液得到氢氧化镁,灼烧Mg(OH)2,Mg(OH)2分解生成MgO,所以蒸干、灼烧氯化镁溶液得到的固体是MgO,故A错误;
B.NaAlO2是强碱弱酸盐,AlO2-水解生成HAlO2和NaOH,因为HAlO2没有挥发性,所以蒸干溶液得到的固体是NaAlO2,NaAlO2受热不易分解,所以蒸干、灼烧偏铝酸钠溶液得到的固体是NaAlO2,故B正确;
C.碳酸铵受热发生的反应为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑,所以蒸干灼烧碳酸氢铵溶液得不到原溶质,故C错误;
D.高锰酸钾受热发生的反应为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,所以蒸干灼烧高锰酸钾溶液得不到高锰酸钾,故D错误;
故选B.
点评 本题以盐类水解为载体考查元素化合物知识,为高频考点,明确物质的性质是解本题关键,只有受热不易分解且水解生成的酸没有挥发性的盐溶液蒸干灼烧得到原来物质,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 氯化钙能与Na2CO3反应,也能与NaHCO3反应 | |
| D. | 与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氢硫酸溶液中加入烧碱,有利于c(S2-)增大 | |
| B. | 经粉碎的黄铁矿燃烧得较快、较完全 | |
| C. | 实验室用排饱和食盐水的方法收集氯气 | |
| D. | 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中含4NA个C-C共价键 | |
| B. | 2L 0.5 moI.L-1盐酸溶液所含的HCI分子数目为NA | |
| C. | 标准状况下,2.24LCL4含有的原子数为0.5NA | |
| D. | 7.1 gCL2与5.6 g Fe反应,转移的电子总数为0,2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
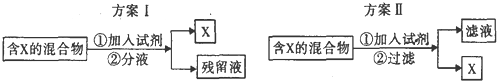
| A. | 若含X的混合物为碘水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液 | |
| B. | 若含X的混合物为乙醇和水,可通过方案Ⅱ进行分离,加入试剂为生石灰 | |
| C. | 若含X的混和物为KNO3和NaCl,可通过方案II进行分离,加入试剂为适量沸水 | |
| D. | 若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
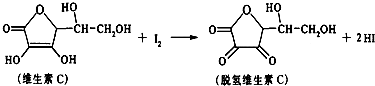
| A. | 上述反应为取代反应 | B. | 滴定时可用淀粉溶液作指示剂 | ||
| C. | 滴定时应剧烈振荡锥形瓶 | D. | 脱氢维生素C的分子式为C6H7O6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com