
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价变为+2价,得到电子被还原;Cl元素的原子失去电子,被氧化;若参加
反应的HCl是73g,由反应可知,$\frac{10}{16}$被氧化,则被氧化的HCl是73g×$\frac{10}{16}$=45.625,
故答案为:+7;+2;还原;Cl;氧化;45.625.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
| B | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Cl?、NO${\;}_{3}^{-}$、Na+、SO${\;}_{3}^{2-}$ | |
| B. | Na2S溶液中:SO42-、K+、Cl?、Cu2+ | |
| C. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| D. | FeCl3溶液中:K+、NH4+、I-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一 | |
| D. | 明矾和氯气均可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废旧电池必须进行集中处理的主要原因是回收其中的碳电极 | |
| B. | 钠、镁等金属着火,可用CO2灭火 | |
| C. | “雨后彩虹”和“海市蜃楼”现象的出现与胶体的性质有关 | |
| D. | “加碘食盐”“含氟牙膏”“富硒营养品”“高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
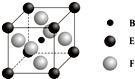 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com