将CO2转化成有机物可有效实现碳循环。下列4个反应是CO2转化成有机物实例:
| | | |
| | 光合作用
练习册系列答案
相关习题
科目:高中化学
来源:
题型:
在一定体积的密闭容器中,进行如下化学反应:CO 2(g)+H 2(g)?CO(g)+H 2O(g) 其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 | 回答下列问题: (1)该反应的化学平衡常数表达式为K= . (2)该反应为 吸热 吸热 反应(选填吸热、放热). (3)能判断该反应是否达到化学平衡状态的依据是 bc bc (双选). a.容器中压强不变 b.混合气体中 c(CO)不变 c.v正(H 2)=v逆(H 2O) d.c(CO 2)=c(CO) (4)某温度下,平衡浓度符合下式:c(CO 2)?c(H 2)=c(CO)?c(H 2O),试判断此时的温度为 830 830 ℃. (5)CO 2是目前大气中含量最高的一种温室气体.因此,控制和治理CO 2是解决温室效应的有效途径.下列措施中,有利于降低大气中CO 2浓度的有: abcd abcd .(填字母) a.减少化石燃料的使用 b.植树造林,增大植被面积 c.采用节能技术 d.利用太阳能、风能 (6)将CO 2转化成有机物可有效实现碳循环,CO 2转化成有机物的例子很多,如: a.6CO 2+6H 2O C 6H 12O 6+6O 2 b.CO 2+3H 2CH 3OH+H 2O c.CO 2+CH 4CH 3COOH d.2CO 2+6H 2CH 2=CH 2+4H 2O 以上反应中,最节能的是 a a ,原子利用率最高的是 c c .
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
(2012?开封二模)由于温室效应和资源短缺等问题,如何降低大气中的CO 2含量并加以开发利用,引起了各国的普遍重视. (1)目前,用超临界CO 2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 保护臭氧层 保护臭氧层 . (2)将CO 2转化成有机物可有效实现碳循环.CO 2转化成有机物的例子很多,如: a.6CO 2+6H 2O C 6H 12O 6+6O 2 b.CO 2+3H 2CH 3OH+H 2O c.CO 2+CH 4CH 3COOH d.2CO 2+6H 2CH 2=CH 2+4H 2O 以上反应中,最节能的是 a a ,原子利用率最高的是 c c . (3)若有4.4kg CO 2与足量H 2恰好完全反应,生成气态的水和甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式 CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol .  (4)为探究用CO 2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充入1mol CO 2和3molH 2,进行反应.测得CO 2和CH 3OH(g)的浓度随时间变化如图所示.从反应开始到平衡v(H 2)= 0.225 mol?L-1?min-1 0.225 mol?L-1?min-1 ;CO 2的转化率= 75% 75% ;该温度下的平衡常数数值= 5.33 5.33 .能使平衡体系中n(CH 3OH)/n(CO 2)增大的措施有 将H2O(g)从体系中分离 将H2O(g)从体系中分离 (任写一条). (5)CO 2在自然界循环时可与CaCO 3反应,CaCO 3是一种难溶物质,其K sp=2.8×10 -9.CaCl 2溶液与Na 2CO 3溶液混合可形成CaCO 3沉淀,现将等体积的CaCl 2溶液与Na 2CO 3溶液混合,若Na 2CO 3溶液的浓度为4×10 -4mol/L,则生成沉淀所需CaCl 2溶液的最小浓度为 2.8×10-5mol/L 2.8×10-5mol/L .
查看答案和解析>>
科目:高中化学
来源:
题型:
工业上制备BaCl 2的工艺流程图如下: 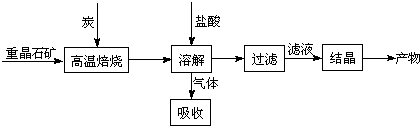 某研究小组在实验室用重晶石(主要成分BaSO 4)对工业过程进行模拟实验.查表得 BaSO 4(s)+4C(s) 4CO(g)+BaS(s)△H 1=571.2kJ?mol -1 ① BaSO 4(s)+2C(s) 2CO 2(g)+BaS(s)△H 2=226.2kJ?mol -1 ② (1)气体用过量NaOH溶液吸收,得到硫化钠.Na 2S水解的离子方程式为 S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH- S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH- . (2)反应C(s)+CO 2(g) 2CO(g)的△H 2= 172.5 172.5 kJ?mol -1. (3)“温室效应”是全球关注的环境问题之一.CO 2是目前大气中含量最高的一种温室气体.因此,控制和治理CO 2是解决温室效应的有效途径. ①下列措施中,有利于降低大气中CO 2浓度的有: abcd abcd .(填字母) a.减少化石燃料的使用 b.植树造林,增大植被面积 c.采用节能技术 d.利用太阳能、风能 ②将CO 2转化成有机物可有效实现碳循环.CO 2转化成有机物的例子很多,如: a.6CO 2+6H 2O C 6H 12O 6 b.CO 2+3H 2CH 3OH+H 2O c.CO 2+CH 4CH 3COOH d.2CO 2+6H 2CH 2═CH 2+4H 2O 以上反应中,最节能的是 a a ,原子利用率最高的是 c c .
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
“温室效应”是全球关注的环境问题之一.CO 2是目前大气中含量最高的一种温室气体.因此,控制和治理CO 2是解决温室效应的有效途径. (1)下列措施中,有利于降低大气中CO 2浓度的有: .(填字母) a.减少化石燃料的使用 b.植树造林,增大植被面积 c.采用节能技术 d.利用太阳能、风能 (2)将CO 2转化成有机物可有效实现碳循环.CO 2转化成有机物的例子很多,如: a.6CO 2+6H 2O C 6H 12O 6+6O 2 b.CO 2+3H 2CH 3OH+H 2O c.CO 2+CH 4CH 3COOH d.2CO 2+6H 2CH 2═CH 2+4H 2O 以上反应中,最节能的是 ,原子利用率最高的是 .(填字母) (3)文献报道某课题组利用CO 2催化氢化制甲烷的研究过程如下: 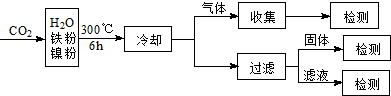 反应结束后,气体中检测到CH 4和H 2,滤液中检测到HCOOH,固体中检测到镍粉和Fe 3O 4.CH 4、HCOOH、H 2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):  研究人员根据实验结果得出结论:HCOOH是CO 2转化为CH 4的中间体, 即:CO 2HCOOH CH 4①写出产生H 2的反应方程式 . ②由图可知,镍粉是 .(填字母) a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂 c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂 ③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 .(填字母) a.反应Ⅰ的速率增加,反应Ⅱ的速率不变 b.反应Ⅰ的速率不变,反应Ⅱ的速率增加 c.反应Ⅰ、Ⅱ的速率均不变 d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 f.反应Ⅰ的速率减小,反应Ⅱ的速率增加.
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
 通过煤的气化和液化,使碳及其化合物得以广泛应用. I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H 2时,存在以下平衡:CO(g)+H 2O(g)?CO 2(g)+H 2(g) (1)向1L恒容密闭容器中充人CO和H 2O(g),800℃时测得部分数据如下表.
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 | 则该温度下反应的平衡常数K= . (2)相同条件下,向2L恒容密闭容器中充入1mol CO、1mol H 2O(g)、2mol CO 2、2mol H 2,此时υ(正) υ(逆)(填“>”“=”或“<”). Ⅱ.已知CO(g)、H 2(g)、CH 3OH(l)的燃烧热分别为283kJ?mol -1、286kJ?mol -1、726kJ?mol -1. (3)利用CO、H 2合成液态甲醇的热化学方程式为 . (4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 . Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y 2O 3的ZrO 2晶体,它在高温下能传导O 2-. (5)以辛烷(C 8H 18)代表汽油,写出该电池工作时的负极反应方程式 . (6)已知一个电子的电量是1.602×10 -19C,用该电池电解饱和食盐水,当电路中通过1.929×10 5C的电量时,生成NaOH g. Ⅳ.煤燃烧产生的CO 2是造成温室效应的主要气体之一. (7)将CO 2转化成有机物可有效地实现碳循环.如: a.6CO 2+6H 2O C 6H 12O 6+6O 2b.2CO 2+6H 2C 2H 5OH+3H 2O c.CO 2+CH 4CH 3COOH d.2CO 2+6H 2CH 2=CH 2+4H 2O 以上反应中,最节能的是 ,反应b中理论上原子利用率为 .
查看答案和解析>>
| |
