

| 催化剂 |
| △ |
| 催化剂 |
| △ |
| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
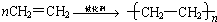 ,故答案为:
,故答案为: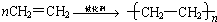 .
.


科目:高中化学 来源: 题型:
| A、向溶液中加少量CaO,达新平衡后,溶液的pH不变 |
| B、向溶液中加少量CaO,达新平衡后,溶液的pH降低 |
| C、向溶液中加入Na2CO3溶液,其中Ca(OH)2固体质量增加 |
| D、向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO4-、K+、Na+、SO42- |
| B、K+,H+,Cl-,CO32- |
| C、Mg2+、NH4+、Cl-、NO3- |
| D、Ba2+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
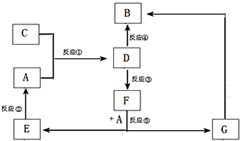 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
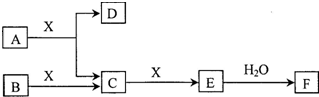 由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp(mol2?L-2) | 3×10-9 | 9×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com