
工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水。某同学想在实验室探究Cl2性质并模拟制备漂水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
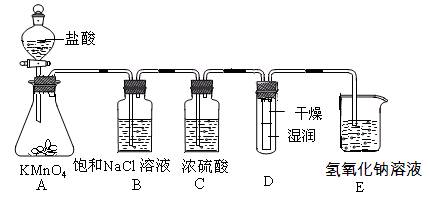
(1)配制物质的量浓度为0.375 mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应的离子方程式为 。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示和文字说明) 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因 ;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂水溶液355g,其中含NaClO的物质的量为 mol。
(13分)
(1)容量瓶(2分)
(2)干燥氯气(1分)
(3)Cl2 + 2OH— = Cl— + ClO— + H2O(2分)
(4)HCl溶于水电离出的H??+和饱和NaCl溶液中的Cl— 都会对反应Cl2 + H2O ![]() H??+ + Cl—+ HClO 起到抑制作用(2分)
H??+ + Cl—+ HClO 起到抑制作用(2分)
(5)不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色。(2分)
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中。或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中。(2分,合理给分)
(6)0.5(2分)


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
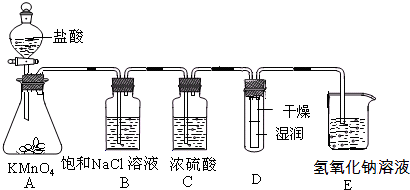
(12分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/L的NaOH溶液中得到漂水。某同学在实验室利用下述实验装置探究Cl2性质并模拟制备漂水。
(1)配制470mL物质的量浓度为0.375 mol/L的NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 。
(2)浓硫酸的作用是______________________。
(3)装置E中发生反应的离子方程式为______________________________________。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示,并配必要的文字说明)
。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
_________________________________________。
(6)如果制得氯元素含量为10%的漂水溶液35.5g,那么其中含NaClO的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省厦门市翔安一中高一上学期期中考试化学试卷 题型:实验题
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。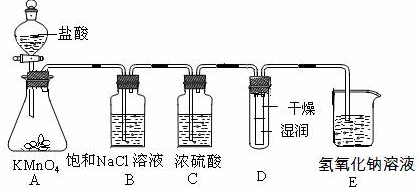
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三上学期期中考试化学试卷 题型:实验题
(12分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/L的NaOH溶液中得到漂水。某同学在实验室利用下述实验装置探究Cl2性质并模拟制备漂水。

(1)配制470mL物质的量浓度为0.375 mol/L的NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 。
(2)浓硫酸的作用是______________________。
(3)装置E中发生反应的离子方程式为______________________________________。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示,并配必要的文字说明)
。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
_________________________________________。
(6)如果制得氯元素含量为10%的漂水溶液35.5g,那么其中含NaClO的物质的量为____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com