
【题目】按要求完成下列填空:
(1)写出下列物质在水溶液中的电离方程式:①H2CO3:_______;②NaHCO3:___________。
(2)完成下列反应的离子方程式:①向NaHSO3溶液中加入过量NaHSO4溶液__;②小苏打溶液与乙酸溶液混合___;③FeBr2溶液中通入过量Cl2:____。
(3)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是(______)
A.无色溶液中:Na+、NH4+、Cu2+、SO42-
B.0.1 mol·L-1的NH4HCO3溶液中:K+、SiO32-、AlO2-、Cl-
C.25 ℃时,Kw/c(H+)=1×10-2 mol·L-1的溶液中:K+、NO3-、S2-、ClO-
D.使甲基橙呈红色的溶液中:NH4+、Ba2+、Al3+、Cl-
(4)200 mL某溶液中有5种离子大量共存,其中4种离子的物质的量如下表:
离子 | H+ | K+ | NO3- | SO42- |
物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
则另外一种离子是________(填写代号),该离子的浓度为________。
A.Fe2+ B.Cl- C.Al3+ D.ClO-
【答案】H2CO3![]() H++HCO3-、HCO3—
H++HCO3-、HCO3—![]() H++CO32- NaHCO3=Na++HCO3- HSO3-+H+=H2O+SO2↑ HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- D C 0.5 mol·L-1
H++CO32- NaHCO3=Na++HCO3- HSO3-+H+=H2O+SO2↑ HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- D C 0.5 mol·L-1
【解析】
(1)碳酸为二元弱酸,电离分步进行,且以第一步为主;碳酸氢钠完全电离生成碳酸氢根离子和钠离子;
(2)①反应生成硫酸钠、水、二氧化硫;②反应生成乙酸钠、水、二氧化碳;③反应生成氯化铁、溴;
(3)首先判断各选项的限制条件的含义,在根据离子共存的常见类型分析判断;
(4)结合电荷守恒及离子共存判断。
(1)H2CO3在水溶液中部分电离,而且分步电离,电离方程式为H2CO3![]() H++HCO3-,HCO3-
H++HCO3-,HCO3-![]() H++CO32-;碳酸氢钠在水溶液中完全电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-,故答案为:H2CO3
H++CO32-;碳酸氢钠在水溶液中完全电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-,故答案为:H2CO3![]() H++HCO3、HCO3-
H++HCO3、HCO3-![]() H++CO32-;NaHCO3=Na++HCO3-;
H++CO32-;NaHCO3=Na++HCO3-;
(2)①向NaHSO3溶液中加入过量NaHSO4溶液的离子反应为HSO3-+H+═H2O+SO2↑,②小苏打溶液与乙酸溶液混合的离子反应为HCO3-+CH3COOH═CH3COO-+H2O+CO2↑,③FeBr2溶液中通入过量Cl2的离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故答案为:HSO3-+H+═H2O+SO2↑;HCO3-+CH3COOH═CH3COO-+H2O+CO2↑; 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-;
(3)A.Cu2+为有色离子,不满足溶液无色的条件,故A错误;B.NH4HCO3与SiO32-、AlO2-反应,在溶液中不能大量共存,故B错误;C.ClO-、S2-之间能够发生氧化还原反应,在溶液中不能大量共存,故C错误;D.使甲基橙呈红色的溶液呈酸性,溶液中存在大量氢离子,NH4+、Ba2+、Al3+、Cl-之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故D正确;故选D;
(4)因H+与ClO-反应,NO3-、H+与Fe2+发生氧化还原反应,不能共存;由表格中数据可知,0.6+0.15×2>0.5+0.1,可知含阳离子,只能为Al3+,其浓度为![]() =0.5mol/L,故答案为:C;0.5 mol/L。
=0.5mol/L,故答案为:C;0.5 mol/L。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4固体,保持温度不变,测得溶液pH为1。对于该溶液,下列叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的c(H+)=1×10-13mol/L
C. c(H+)+c(Na+)=c(OH-)+2c(SO42-)
D. 该温度下加入等体积pH为11的KOH溶液,可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 1 mol Cl2参加反应转移电子数一定为2NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C. 根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀)>HNO3(浓)
NO2可知,氧化性:HNO3(稀)>HNO3(浓)
D. 含有大量NO3—的溶液中,不能同时大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应3B(g) ![]() C(g)+D(g)的说法不正确的是( )
C(g)+D(g)的说法不正确的是( )
A.某时刻测得v正(B)=v逆(B),说明反应达到了化学平衡状态
B.反应达到化学平衡后,反应物和生成物的浓度不再改变
C.反应达到平衡后,反应就停止了
D.上述反应中,B不可能全部转化为C和D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1硫酸溶液480 mL。根据这种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是____ (填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。
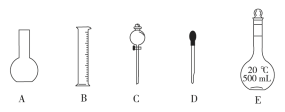
(2)下列操作中,是容量瓶所具备的功能有__________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.稀释某一浓度的溶液 E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________。
(4)下列操作会使配制的硫酸溶液浓度偏低的是__________。
A.俯视刻度线定容 B.选用的容量瓶内有少量蒸馏水 C.定容摇匀后,液面下降,又加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
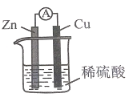
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是
A. 金属Mg与稀硫酸、CO2均能反应,但其基本反应类型不同
B. 浓硫酸与铜反应时,既体现了其强氧化性又体现了其酸性
C. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
D. SO2气体通入Ba(NO3)2溶液中,有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com