
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
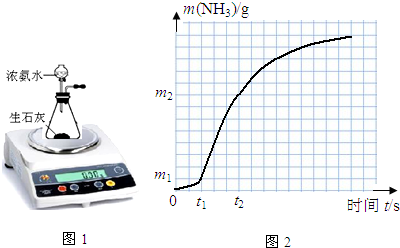
分析 (1)实验目的是通过装置反应前后质量变化来测氨气的产生速率,产生的氨气中有水蒸气,不能离开装置,否则产生误差;实验通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量,可知氨气的反应速率;通过控制变量法设计实验;
(2)①根据图象计算t1~t2之间生成NH3的物质的量,即消耗NH3•H2O的量,由于忽略溶液体积变化,所以v(NH3•H2O)=$\frac{△c}{△t}$;
②浓度和温度对反应速率的影响.
解答 解:(1)实验目的是通过装置反应前后质量变化来测氨气的产生速率,产生的氨气中有水蒸气,不能离开装置,否则产生误差,所以用装碱石灰的干燥管吸收水蒸气;实验通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量,可知氨气的反应速率;实验1和实验2探究固体比表面积,让其他条件相同,氧化钙的状态不同,所以实验2为块状;实验1和实验3探究氨水浓度对v(NH3)的影响,让氧化钙的状态相同,氨水的浓度不同,控制溶液的总体积相同,实验3说明总体积为40mL,所以实验1、2水的体积都为10mL,
故答案为: ;产生等质量的NH3所需的时间或相同时间内生成NH3的质量;
;产生等质量的NH3所需的时间或相同时间内生成NH3的质量;
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | 产生等质量的NH3所需的时间t/s | |
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 10 | t1 | ||
| 实验2 | 10 | 块状 | t2 | ||
| 实验3 | 粉末状 | t3 |
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | 相同时间内生成NH3的质量m/g | |
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 10 | m1 | ||
| 实验2 | 10 | 块状 | m2 | ||
| 实验3 | 粉末状 | m3 |
点评 本题探究影响化学反应速率的因素,用控制变量法设计实验,化学反应速率的计算和浓度、温度对反应速率的影响的应用考查,难度适中.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S分子呈V形 | |
| B. | H2S沸点低于H2O沸点,因为S-H键键能低 | |
| C. | H2S分子中只含σ键 | |
| D. | H2S分子稳定性低于H2O分子,因为O-H键键能高 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
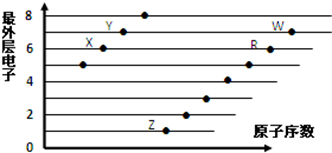
| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com