
| A、c(Na+)+c(H+)>c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b |
| D、若a=b,则溶液中c(HCO3-)>c(CO32-) |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
 矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、x+y<z |
| C、C的体积分数提高 |
| D、B的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H=+571.6kJ?mol-1 | ||
| B、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ?mol-1 | ||
C、H2(g)+
| ||
D、H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
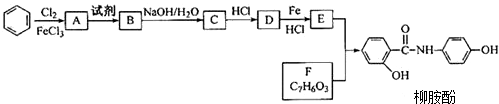
 .请回答下列问题:
.请回答下列问题: 的化学方程式
的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
B、 32gS8单质中含有的S-S键个数为NA(见图) |
| C、10L 0.1mol/L Na2S的水溶液中,S2-、HS-两种微粒数之和为NA个 |
| D、标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与氢氧化钠溶液反应:2Al+2OH-+H2O=2AlO2-+2H2↑ |
| B、氯化铁溶液与铁单质反应:Fe3++Fe=2Fe2+ |
| C、钠投入硫酸铜溶液中:2Na+Cu2+═2Na++Cu |
| D、碳酸氢钠溶液中加入烧碱溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、在冰醋酸中这四种酸都没有完全电离 |
| B、在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C、在冰醋酸中硫酸的电离方程式为 H2SO4=2H++SO42- |
| D、水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com