
(16分)软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:

已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
Ksp 阳离子 | CO32- | F- | OH- |
Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
Zn2+ | 1.2×10-10 | 3.0×10-2 | 6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
(1)MnO2+SO2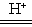 Mn2++SO42-
Mn2++SO42-
(2)Fe2O3+6H+=2Fe3++3H2O;2Fe3++SO2+2H2O=2Fe2++4H++SO42-
(3)Fe(OH)3、Al(OH)3;石灰水 (4)MnF2
(5)防止温度下降时MnSO4H2O溶解,导致产率降低
【解析】
试题分析:(1)浸出过程中MnO2被SO2还原转化为Mn2+的离子方程式为MnO2+SO2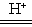 Mn2++SO42-。
Mn2++SO42-。
(2)浸出过程中Fe2O3与酸反应生成铁离子,铁离子被SO2还原转化为亚铁离子,则转化为Fe3+和Fe2+的离子方程式为Fe2O3+6H+=2Fe3++3H2O;2Fe3++SO2+2H2O=2Fe2++4H++SO42-。
(3)双氧水把亚铁离子氧化为铁离子,根据金属阳离子沉淀时的pH值可知pH在5到6之间时生成的沉淀是氢氧化铁和氢氧化铝,及滤渣1的主要成分是Fe(OH)3、Al(OH)3;要增大溶液的pH则需要加入氢氧化钙,硫酸是强酸,不能选择,则调pH至5~6所加的试剂是石灰水。
(4)由于不能引入杂质,则阳离子选择锰离子。又因为要沉淀溶液中的镁离子和钙离子,则A的溶度积常数不能太小,所以根据下表数据可知“第2步除杂”所加的物质A MnF2。
(5)由于温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低,所以为防止温度下降时MnSO4·H2O溶解,导致产率降低,因此需要“趁热过滤”。
考点:考查物质制备工艺流程图的分析与应用


科目:高中化学 来源:2014-2015甘肃省天水市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期12月联考化学试卷(解析版) 题型:选择题
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m克与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是

A.a b时的沉淀成分为BaSO4与Mg (OH) 2
b时的沉淀成分为BaSO4与Mg (OH) 2
B.原混合溶液中:n(HCl)=2mol
C.c点时的溶液中c (Cl-)>c(OH-)>c(Ba2+)
D.b c时发生的离子反应为H++OH-=H2O
c时发生的离子反应为H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术](15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O —NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
W | X | Y |
Z |
A.四种元素的原子半径:rZ>rX>rY>rW
B.四种元素形成的单质最多有6种
C.四种元素均可与氢元素形成电子总数为18的分子
D.四种元素中,Z的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三1月模拟考试理综化学试卷(解析版) 题型:选择题
如图所示的电化学装置,下列叙述正确的是
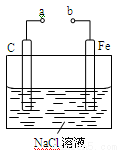
A.a和b用导线连接,电子由碳经过导线流向铁
B.a和b用导线连接,铁电极的电极反应为:Fe-3e-=Fe3+
C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀
D.a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三一轮复习基础知识检测化学试卷(解析版) 题型:填空题
(12分)按要求完成下列各小题。

(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法正确的是 (填序号)。
a.分子中碳原子与氮原子的个数比是7 : 5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)写出丙物质与足量NaOH溶液共热的化学方程式 。
(4)已知以下信息:


1molB经上述反应可生成2molC,且C不能发生银镜反应。
则由A生成B的化学方程式为
(5) 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(6)已知有下列反应:
试写出只用1,3-丁二烯合成六元环化合物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三一轮复习基础知识检测化学试卷(解析版) 题型:选择题
化学与生活密切相关。下列有关的说法中不正确的是
A.宇宙飞船中使用的碳纤维,是一种新型无机非金属材料
B.氢氧化铁溶胶、含塑化剂的白酒、含有细菌的矿泉水均具有丁达尔效应
C.“地沟油”经过加工处理后,可以用于制肥皂和生物柴油
D.化石燃料的大量使用是产生PM2.5的主要原因之一
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是
A. Na+、NO3-、AlO2-、SO42- B. Na+、Al3+、NO3-、SO42-
C. Na+、Mg2+、Cl-、HCO3- D. K+、Cl-、AlO2-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com