
| A. | 常温下,1 mol•L-1甲酸溶液的pH值约为2 | |
| B. | 甲酸电离出的阳离子全部是H+ | |
| C. | 10mL1 mol•L-1甲酸与10 mL1 mol•L-1NaOH溶液完全反应后,溶液呈碱性 | |
| D. | 1LH+浓度为0.1 mol•L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L |
分析 A.根据氢离子浓度与酸的浓度的关系判断;
B.根据氢离子浓度判断是否完全电离,若完全电离,是强电解质,反之是弱电解质;
C.根据盐溶液是否水解判断;
D.弱电解质部分电离,酸的浓度大于氢离子浓度.
解答 解:A.1mol•L-1甲酸溶液的pH值约为2,则溶液的氢离子的浓度为0.01mol•L-1,酸的浓度大于氢离子的浓度,说明酸部分电离,为弱电解质,故A正确;
B.甲酸电离出的阳离子全部是H+,不能说明酸是否完全电离,所以不能证明它是弱电解质,故B错误;
C.10mL 1mol•L-1甲酸与10mL 1mol•L-1 NaOH溶液完全反应生成甲酸钠,溶液呈碱性,说明甲酸钠中甲酸根离子水解,即甲酸为弱电解质,故C正确;
D.1L H+浓度为0.1mol•L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L,说明溶液中酸的浓度大于氢离子的浓度,说明甲酸是弱电解质,故D正确.
故选B.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:计算题
| 物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
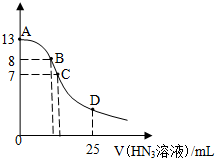 常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )| A. | A点水电离出的c(H+)小于B点 | |
| B. | 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5mL | |
| D. | 在D点,c(H+)≈10-4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
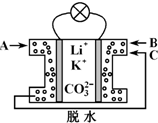 熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )| A. | Li+、K+移向左侧电极 | |
| B. | 外电路中电子由右侧电极移向左侧电极 | |
| C. | 通入1 mol气体A时,左侧电极上生成5 mol CO2 | |
| D. | 相同条件下通入气体B与气体C的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )| A. | 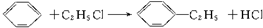 | B. |  | ||
| C. | 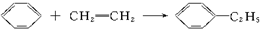 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度 | |
| B. | 恒温恒容再充入a mol CO和2a mol H2 | |
| C. | 恒温恒容再充入H2 | |
| D. | 充入Ar(g)使体系的总压增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com