
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | - | 5.61×10-11 |
| A. | NaClO溶液中通入少量CO2:ClO-+H2O+CO2═HCO3-+HClO | |
| B. | 氯水中加入少量NaCO3粉末:HCO3-+H+═H2O+CO2↑ | |
| C. | NaClO溶液中通入少量SO2:2ClO-+H2O+SO2═SO32-+2HClO | |
| D. | Na2CO2溶液中缓慢通入少量SO2:2CO32-+H2O+SO2═SO32-+2HCO3- |
分析 依据电离常数大小判断酸性强弱,H2SO3>HSO3->H2CO3>HClO>HCO3-,
A.次氯酸钠通入少量二氧化碳反应生成次氯酸和碳酸氢钠;
B.氯水中加入少量NaCO3粉末,氯水中的盐酸与碳酸钠反应生成氯化钠、水和二氧化碳;
C.次氯酸具有强的氧化性,能够氧化二氧化硫;
D.二氧化硫少量反应生成亚硫酸钠和碳酸氢钠.
解答 解:A.NaClO溶液中通入少量CO2,离子方程式为ClO-+H2O+CO2═HCO3-+HClO,故A正确;
B.氯水中加入少量NaCO3粉末,离子方程式为HCO3-+H+═H2O+CO2↑,故B正确;
C.NaClO溶液中通入少量SO2,发生氧化还原反应,二氧化硫被氧化,离子方程式为H2O+ClO-+SO2=Cl-+SO42-+2H+,故C错误;
D.Na2CO3溶液中缓慢通入少量SO2,离子方程式为2CO32-+H2O+SO2═SO32-+2HCO3-,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,侧重考查强酸制备弱酸的原理,依据图中电离常数判断酸性强弱是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
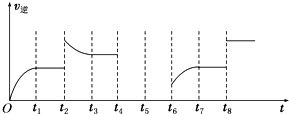 丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.
丙烷是液化石油气的主要成分,在燃烧时能放出大量的热,作为能源广泛应用于生产和日常生活中.| 容器 编号 | 起始时各物质 的物质的量/mol | 达到平衡 的时间/min | 达到平衡时 体系能量的 变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出热量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1、2 | B. | 2、3 | C. | 3、6 | D. | 4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
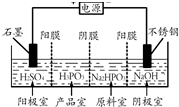 亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH | |
| B. | 实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 | |
| C. | 可用重结晶法提纯含少量NaCl的KNO3晶体 | |
| D. | 容量瓶、滴定管上都标有使用温度,容量瓶无“O”刻度,滴定管有“O”刻度,使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述元素中,Y的原子半径最大 | |
| B. | 上述元素中,W的气态氢化物最稳定 | |
| C. | 元素W和X可形成含有极性键的极性分子WX3 | |
| D. | 工业上可用电解熔融的Y、Z的化合物的方法冶炼Y、Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
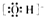
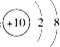

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用废油脂制肥皂 | |
| B. | 袋装食品常用生石灰包作为食品的抗氧化剂 | |
| C. | 配制CuSO4溶液时加入少量的稀硫酸 | |
| D. | 用钠和钠的化合物做焰色反应实验,焰色均为黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com