
| A. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 | |
| B. | 12g金刚石中,含C-C共价键键数为4mol | |
| C. | 水晶、干冰熔化时克服粒子间作用力的类型相同 | |
| D. | 熔点由高到低的顺序是:晶体硅>碳化硅>金刚石 |
分析 A.离子晶体熔化时,破坏离子键;而分子晶体熔化时破坏分子间作用力;
B.金刚石晶体中,每个C原子占有2个C-C键;
C.原子晶体熔化时克服共价键,分子晶体熔化时破坏分子间作用力;
D.原子晶体熔点高低与键长成反比.
解答 解:A.离子晶体熔化时,破坏离子键;而分子晶体熔化时破坏分子间作用力,化学键不被破坏,故A正确;
B.12g金刚石的物质的量是1mol,金刚石晶体中,每个C原子占有2个C-C键,所以12g金刚石中,含C-C共价键键数为2mol,故B错误;
C.原子晶体熔化时克服共价键,分子晶体熔化时破坏分子间作用力,水晶属于原子晶体、干冰属于分子晶体,所以水晶熔化时破坏共价键、干冰熔化时破坏分子间作用力,故C错误;
D.原子晶体熔点高低与键长成反比,键长大小顺序是:Si-Si>C-Si>C-C,所以熔点由高到低的顺序是:晶体硅<碳化硅<金刚石,故D错误;
故选A.
点评 本题考查化学键和晶体的关系,明确物质的构成微粒是解本题关键,根据微粒间的作用力分析解答,易错选项B,注意采用均摊法分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
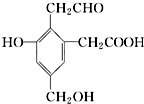 ,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的
,分别取钠、氢氧化钠、新制氢氧化铜悬浊液分别与等物质的量的| A. | 6:4:5 | B. | 3:2:3 | C. | 3:2:2 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 600.20 kJ•mol-1 | B. | +1200.40 kJ•mol-1 | ||
| C. | -1965.08 kJ•mol-1 | D. | -1200.40 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子晶体中不可能存在非极性键 | |
| B. | 在共价化合物的分子晶体中不可能存在离子键 | |
| C. | 在极性分子中不可能存在非极性键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3是非极性分子 | B. | PH3分子中的P-H 键是非极性键 | ||
| C. | PH3中心原子杂化轨道类型为sp2型 | D. | PH3分子中有未成键的电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
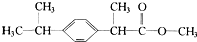
| A. | X难溶于水,易溶于有机溶剂 | B. | X能与液溴在一定条件下发生反应 | ||
| C. | X与酸、碱溶液均可以反应 | D. | X的水解产物能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、Na+、K+、HCO3- | B. | Na+、K+、Cl-、Ag+ | ||
| C. | Mg+、SO42-、Na+、NO3- | D. | MnO4-、Fe2+、CO32-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都显碱性 | B. | 它们都有强还原性 | ||
| C. | 它们都能跟H2O、O2反应 | D. | Na只有还原性,Na+只有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com