
含氮废水进入水体中对环境选成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原成N2,从而消除污染。
(1) 配平以下有关的离子反应方程式:
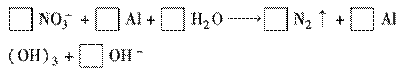
(2)以上反应中失电子的物质是________,还原产物是________,每生成1 mol这种还原产物,将有________电子发生转移。
(3)现需除去1  m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
(4)你对以上治理污染的方案有何评价?
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA
B.常温下,14 g C2H4和C3H6的混合气体中含有2NA个氢原子
C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
D.1 mol甲醇中含有C—H键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=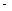 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=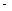 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________[来源:全,品…中&高*考+网]
2CO(g)+2H2(g) 的△H=________________[来源:全,品…中&高*考+网]
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
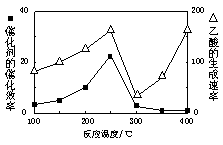
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
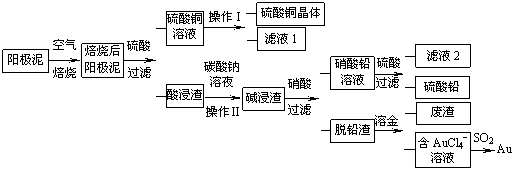

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
Li2NH+H2===LiNH2+LiH。下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三个氧化还原反应:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2===2FeCl3;③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑.
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可有于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究 。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L -1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体 产物是________。
产物是________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是________,现象是____________________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:_____________________________;
假设2:____________________________________;
假设3:________________________________。
②设计实验方案证明你的假设。
③实验过程
根据②中方案进行实验。在下表中写出实验步骤、预期现象与结论。
| 实验步骤 | 预期现象与结论 |
| 步骤1 | |
| 步骤2 | |
| 步骤3 | |
| …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一种固体化合物,本身不导电,但在熔融状态下或溶于水时能够电离。下列说法中正确的是( )
A.该物质一定为电解质
B.该物质可能为非电解质
C.该物质一定是氯化钠
D.该物质一定是氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com