
【题目】含氮化合物在工农业生产、生活中有重要作用。
Ⅰ.有资料显示过量的NH3和Cl2在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
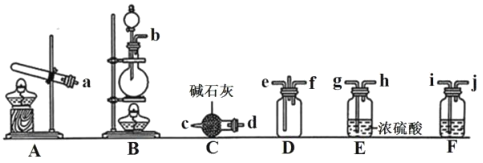
①利用装置A制取实验所需的NH3,写出反应的化学方程式__。
②已知该实验中用浓盐酸与MnO2反应制取所需Cl2,其离子反应方程式为__;装置F中的试剂是__。(填名称)
③为了使NH3和Cl2在D中充分混合,则由__(填e或f)通入NH3;请确定上述装置的合理连接顺序:A→__→D←__←__←__(用大写字母和箭头表示,箭头方向与气流方向一致)。
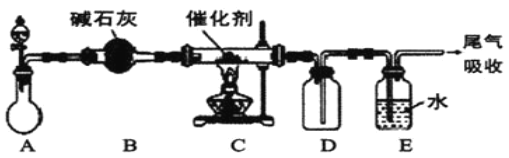
Ⅱ.(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是__。(填化学式)
②C装置中发生反应的化学方程式为__。
③反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是__,该离子的检验方法为__。
④下列哪些装置可以同时起到装置D和E的作用__(填代号)。
a. b.
b.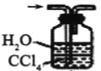 c.
c.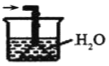 d.
d.
Ⅲ.饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原成N2。
(1)配平方程式:__Al+__NO3-+__OH-=__AlO2-+__N2↑+__H2O。
(2)上述反应中,当有0.3mol电子转移时,产生的氮气在标准状况下的体积为__mL。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O MnO2+4H++2Cl-
CaCl2+2NH3↑+2H2O MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 e C E F B Na2O2 4NH3+5O2
Mn2++Cl2↑+2H2O 饱和食盐水 e C E F B Na2O2 4NH3+5O2![]() 4NO+6H2O NH4+ 取E中少许溶液放入一支洁净试管中,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+ b 10 6 4 10 3 2 672
4NO+6H2O NH4+ 取E中少许溶液放入一支洁净试管中,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+ b 10 6 4 10 3 2 672
【解析】
(1)①装置A是用氯化铵和氢氧化钙反应制取NH3,反应方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②浓盐酸与MnO2加热生成氯化锰、氯气、水,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;装置F的作用是除去氯气中的氯化氢,盛放的试剂是饱和食盐水;
Mn2++Cl2↑+2H2O;装置F的作用是除去氯气中的氯化氢,盛放的试剂是饱和食盐水;
③氨气的密度比氯气小,为了使NH3和Cl2在D中充分混合,长管通入氨气、短管通入氯气,即由e通入NH3;A制取氨气经C干燥后通入D,B中制取的氯气经F除去氯化氢、再经E干燥后通入D,合理连接顺序:A→C→D←E←F←B;
Ⅱ.(1)①氨气和氧气在催化剂条件下发生催化氧化,所以A装置中能同时制备氨气和氧气; A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是Na2O2;
②C装置中氨气和氧气在催化剂条件下加热生成一氧化氮和水,发生反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
③反应后,氨气可能进入E,E中的阳离子可能是NH4+;铵根离子遇碱放出氨气,检验铵根离子的方法是:取E中少许溶液放入一支洁净试管中,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+;
④a装置气体吸收不充分,故不选a;b装置,二氧化氮、氨气不溶于四氯化碳,b可以同时起到装置D和E的作用,故选b;c装置不能防倒吸,故不选c;d装置不能防倒吸,故不选d;
Ⅲ.(1)铝元素化合价由0升高为+3、氮元素化合价由+5降低为0,根据得失电子守恒、电荷守恒配平离子方程式10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。
(2)10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,氮元素化合价由+5降低为0,生成1molN2转移10mol电子,当有0.3mol电子转移时,产生的氮气的物质的量是0.03mol,在标准状况下的体积为0.03mol×22.4L/mol=0.672L=672mL。


科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )

A. X是N2O5
B. 可用排水法收集NO、NO2气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 由NH3→N2,从原理上看,NH3可与NO2反应实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得千燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测不正确的是 ( )
A. K+一定存在 B. Ba2+、Mg2+一定不存在
C. Cl- 一定存在 D. 混合溶液中CO32-的浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料。
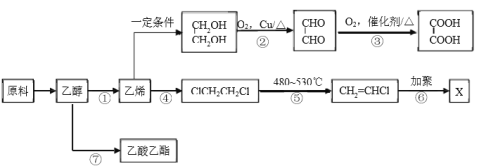
(1)反应②、③实现了官能团的转化:-OH→____________→_____________。
(2)反应④的类型是_______________。
(3)X的结构简式是____________________。
利用如图装置实现反应⑦。
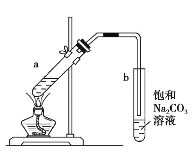
(4)⑦的化学方程式是_________________。
(5)反应结束后,振荡试管b,静置后的现象是__________________。
(6)上述装置中饱和碳酸钠溶液的作用是_______________(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是
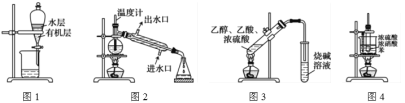
A.用图1所示装置分离用苯萃取碘水后已分层的有机层和水层
B.用图2所示装置进行石油的分馏
C.用图3所示装置制备少量的乙酸乙酯
D.用图4所示装置制取硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
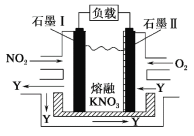
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
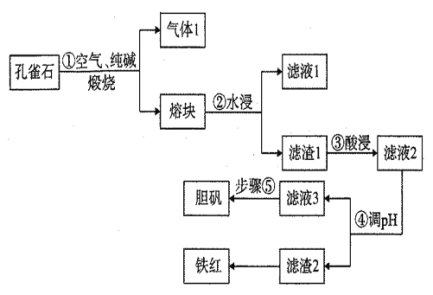
(1)气体1的成分除H2O(g)外,还有CO2、SO2,写出步骤①中发生氧化还原反应的化学方程式为 _______________,若反应生成1mol SO2,则反应中转移的电子数为___________mol。滤液1的主要成分为__________(写化学式)
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有_________________(答出两点)。
(3)步骤④调pH所用试剂为_____________ (写化学式)
(4)常温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=___________。
(5)步骤⑤操作为_______________________________________________________.。
(6)假设使用孔雀石矿石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则:
①铁红的用途之一为________,
②孔雀石矿石中铁元素的含量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com