
下列关系不正确的是( )
|
| A. | 原子半径:K>Na>Mg>N | B. | 酸性:HNO3>H3PO4>H2SiO3 |
|
| C. | 稳定性:HF<H2O<H2S | D. | 酸性:HClO4>H2SO4>H3PO4 |
考点:
同一周期内元素性质的递变规律与原子结构的关系;同一主族内元素性质递变规律与原子结构的关系.
分析:
A、电子层数越多半径越大,电子层数相同时核电荷数越多半径越小;
B、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C、元素的非金属性越强,对应的氢化物越稳定;
D、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.
解答:
解:A、电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,钾的电子层数最多,而氮的电子层最少,钠与镁电子层数相同而钠的核电荷数少,所以半径的大小为:K>Na>Mg>N,故A正确;
B、非金属性N>P>Si,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:HNO3>H3PO4>H2SiO3,故B正确;
C、非金属性S<O<F,元素的非金属性越强,对应的氢化物越稳定,所以热稳定性:H2S<H2O<HF,故C错误;
D、非金属性Cl>S>P,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:HClO4>H2SO4>H3PO4,故D正确;
故选:C.
点评:
本题考查非金属元素的性质,明确同周期、同主族元素的性质变化规律及元素非金属性的比较方法是解答本题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列溶液中粒子的物质的量浓度关系正确的是()
A. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32﹣)>c(HCO3﹣)>c(OH﹣)
B. 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO﹣)>c(Cl﹣)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl﹣)+c(H+)>c(NH4+)+c(OH﹣)
D. 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH﹣)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
若发现了116号元素,并知它是第ⅥA族元素,则下列说法中不正确的是( )
|
| A. | 其钠盐的化学式为Na2X |
|
| B. | 最高价氧化物对应水化物为碱 |
|
| C. | X是金属元素 |
|
| D. | X单质是能导电的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分别由氕(1H)、氘(2H)、氚(3H)组成的单质(均为双原子分子),其质量均为1g,则它们:
(1)原子个数比为 .
(2)电子个数比为 .
(3)相同条件下的密度之比为 .
(4)相同条件下的体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)⇌2HBr(g)△H<0,g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b.a与b的关系是()
A. a>b B. a=b C. a<b D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是()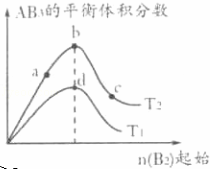
A. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为b>a>c
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2﹣和C﹣,B2+和C﹣具有相同的电子层结构,下列说法正确的是( )
A. C元素的最高正价为+7价 B. 原子半径:A>B>C
C. 离子半径:A2﹣>C﹣>B2+ D. 还原性:A2﹣<C﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com