
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。

完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________(填字母,下同)。
a.烧杯 b.玻璃棒
c.量筒 d.容量瓶
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收________________。
(3)上述装置中,B物质是________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重。为了将石蜡和碳酸钙溶出,应选用的试剂是________。
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________。
(6)上述测定实验中,连续________,说明样品已经恒重。
【解析】 (1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒。
(2)根据实验所用药品,制得的气体中可能含有H2S、HCl和水蒸气;根据除杂的要求,除去H2S可选用CuSO4溶液或酸性KMnO4溶液;碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体。
(3)B物质用于干燥制得的CO2,可选用无水CaCl2或P2O5;其失效时,会造成测定结果偏低。
(4)根据实验步骤,为将石蜡和碳酸钙溶出,可选用稀醋酸溶出碳酸钙,正己烷溶出石蜡。
(5)由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3。
(6)称重时,当连续两次称量的结果相差不超过(或小于)0.1 g,说明达到恒重。
【答案】 (1)abc (2)CuSO4或酸性KMnO4 HCl气体或酸性气体 (3)无水CaCl2或P2O5 偏低 (4)bd
(5)石蜡 CaCO3
(6)两次称量的结果相差不超过(或小于)0.1 g


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述中,正确的是
①过渡金属配合物远比主族金属配合物多
② Cu(H2O)42+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键,1mol该配合物中含有σ键的数目为6NA
③配位化合物中必定存在配位键
④配位键仅存在于配位化合物中
A.①②④ B.①④ C.①③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:


下列叙述错误的是( )
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
柑橘中柠檬烯的结构可表示为 ,下列关于这种物质的说法中正确的是
,下列关于这种物质的说法中正确的是
( )
A.与苯的结构相似,性质也相似
B.可使溴的四氯化碳溶液褪色
C.易发生取代反应,难发生加成反应
D.该物质极易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
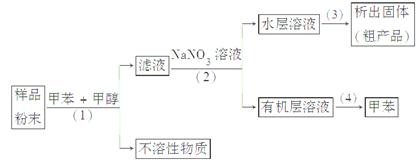
下列说法错误的是( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.用铂作电极电解MgCl2溶液:2Cl-+2H2O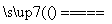 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.用石墨作电极电解氯化铜溶液的总反应:Cu2++2Cl-+2H2O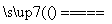 Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C.用石墨作电极电解硫酸氢钠溶液的总反应:2H2O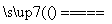 2H2↑+O2↑
2H2↑+O2↑
D.电解熔融的氯化钠制取钠时,阳极上的反应为Na++e-===Na
查看答案和解析>>
科目:高中化学 来源: 题型:
某充电电池的原理如图186所 示,
示, 溶液中c(H+)=2.0 mol·L-1,阴离子为SO
溶液中c(H+)=2.0 mol·L-1,阴离子为SO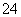 ,a、b均为惰性电极,充电时,右槽溶液的颜色由绿色变为紫色。下列对此电池叙述正确的是( )
,a、b均为惰性电极,充电时,右槽溶液的颜色由绿色变为紫色。下列对此电池叙述正确的是( )

图186
A.放电过程中,左槽溶液的颜色由黄色变为蓝色
B.充电过程中,a极的反应式为VO +2H++e-===VO2++H2O
+2H++e-===VO2++H2O
C.充电时,b极接直流电源的正极,a极接直流电源的负极
D.放电时,当转移1.0 mol电子时,共有2.0 mol H+从右槽迁移至左槽
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是( )
A、该反应中肼作还原剂
B、液态肼的燃烧热为20.05 kJ·mol-1
C、该动力源的突出优点之一是生成物对环境污染小
D、肼和过氧化氢反应的热化学方程式为:
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O2  2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为
A.0.1s B.2.5s C.5s D.10s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com