
| A£® | ÉĻŹöĘųĢ¬»ÆŗĻĪļ·Ö×ÓÖŠĖłÓŠŌ×Ó×īĶā²ćµē×ÓŹż¾łĪŖ8 | |
| B£® | X”¢N”¢Z¶¼æÉÓėWŠĪ³É¼ČÓŠ¼«ŠŌ¹²¼Ū¼üÓÖÓŠ·Ē¼«ŠŌ¹²¼Ū¼üµÄ»ÆŗĻĪļ | |
| C£® | »ÆŗĻĪļW4XY2ZæÉÄÜŹĒĄė×Ó»ÆŗĻĪļ£¬Ņ²æÉÄÜŹĒ¹²¼Ū»ÆŗĻĪļ | |
| D£® | ·Šµć£ŗW2Z£¾YW3£¾XW4 |
·ÖĪö ¶ĢÖÜĘŚŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬WµÄŅõĄė×ÓµÄŗĖĶāµē×ÓŹżÓėĘäĖūČżÖÖŌŖĖŲŌ×ÓµÄÄŚ²ćµē×ÓŹżĻąĶ¬£¬¶ųŅõĄė×Ó×īĶā²ćµē×ÓŹżĀś×ćĪČ¶Ø½į¹¹£¬ÓÉÓŚ¶ĢÖÜĘŚŌŖĖŲŌ×ÓÄŚ²ćµē×ÓŹżĪŖ2»ņ8£¬æÉĶĘÖŖWŅõĄė×ÓŗĖĶāµē×ÓŹżĪŖ2£¬¹ŹWĪŖHŌŖĖŲ£»X”¢Y”¢Z¾ł“¦ÓŚµŚ¶žÖÜĘŚ£¬X”¢Y¾łÄÜÓėZ·Ö±šŠĪ³ÉŌ×ÓøöŹż±ČĪŖ1£ŗ1”¢1£ŗ2µÄĘųĢ¬»ÆŗĻĪļ£¬æÉĶĘÖŖXĪŖC”¢YĪŖN”¢ZĪŖO£¬CŌŖĖŲÓėŃõŌŖĖŲŠĪ³ÉC2H2”¢C2H4£¬NŌŖĖŲÓėOŌŖĖŲŠĪ³ÉNO2”¢N2O4£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗ¶ĢÖÜĘŚŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬WµÄŅõĄė×ÓµÄŗĖĶāµē×ÓŹżÓėĘäĖūČżÖÖŌŖĖŲŌ×ÓµÄÄŚ²ćµē×ÓŹżĻąĶ¬£¬¶ųŅõĄė×Ó×īĶā²ćµē×ÓŹżĀś×ćĪČ¶Ø½į¹¹£¬ÓÉÓŚ¶ĢÖÜĘŚŌŖĖŲŌ×ÓÄŚ²ćµē×ÓŹżĪŖ2»ņ8£¬æÉĶĘÖŖWŅõĄė×ÓŗĖĶāµē×ÓŹżĪŖ2£¬¹ŹWĪŖHŌŖĖŲ£»X”¢Y”¢Z¾ł“¦ÓŚµŚ¶žÖÜĘŚ£¬X”¢Y¾łÄÜÓėZ·Ö±šŠĪ³ÉŌ×ÓøöŹż±ČĪŖ1£ŗ1”¢1£ŗ2µÄĘųĢ¬»ÆŗĻĪļ£¬æÉĶĘÖŖXĪŖC”¢YĪŖN”¢ZĪŖO£¬CŌŖĖŲÓėŃõŌŖĖŲŠĪ³ÉC2H2”¢C2H4£¬NŌŖĖŲÓėOŌŖĖŲŠĪ³ÉNO2”¢N2O4£®
A£®ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬CŌŖĖŲÓėŃõŌŖĖŲŠĪ³ÉC2H2”¢C2H4ÖŠŗ¬ÓŠHŌŖĖŲ£¬HŌ×ÓŅ»¶Ø²»Āś×ć8µē×Ó½į¹¹£¬¹ŹA“ķĪó£»
B£®CŌŖĖŲÓėHŌŖĖŲŠĪ³ÉC2H6µČ£¬NŌŖĖŲÓėHŌŖĖŲæÉŅŌŠĪ³ÉN2H4£¬OŌŖĖŲÓėHŌŖĖŲæÉŅŌŠĪ³ÉH2O2£¬¼ČÓŠ¼«ŠŌ¹²¼Ū¼üÓÖÓŠ·Ē¼«ŠŌ¹²¼Ū¼ü£¬¹ŹBÕżČ·£»
C£®»ÆŗĻĪļH4CN2O£¬æÉÄÜĪŖNH4CNO£¬æÉÄÜĪŖCO£ØNH2£©2£¬Ē°ÕߏōÓŚĄė×Ó»ÆŗĻĪļ£¬ŗóÕߏōÓŚ¹²¼Ū»ÆŗĻĪļ£¬¹ŹCÕżČ·£»
D£®³£ĪĀĻĀĖ®ĪŖŅŗĢ¬£¬¶ų¼×Ķ锢°±ĘųĪŖĘųĢ壬¹ŹĖ®µÄ·Šµć×īøߣ¬¶ų°±Ęų·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£¬·ŠµćøßÓŚ¼×Ķ飬¹Ź·Šµć£ŗH2O£¾NH3£¾CH4£¬¹ŹDÕżČ·£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é½į¹¹ŠŌÖŹĪ»ÖĆ¹ŲĻµÓ¦ÓĆ£¬ĶʶĻŌŖĖŲŹĒ½āĢā¹Ų¼ü£¬A֊עŅāŗ¬ÓŠHŌ×ӵķÖ×ÓŅ»¶Ø²»Āś×ć·Ö×ÓÖŠĖłÓŠŌ×ÓĀś×ć8µē×Ó½į¹¹£¬CŃ”ĻīĪŖŅדķµć”¢ÄŃµć£¬Ń§Éś¶ŌHCNOĖį²»ŹģĻ¤£®


 ³ö²ŹĶ¬²½“óŹŌ¾ķĻµĮŠ“š°ø
³ö²ŹĶ¬²½“óŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | õ„µÄŅ»°ćĶØŹ½ŹĒRCOOR”äŗĶR”äæÉŅŌĻąĶ¬£¬Ņ²æÉŅŌ²»Ķ¬ | |
| B£® | RCOOR”äŗĶR”äæÉŅŌŹĒÖ¬·¾Ģž»ł£¬Ņ²æÉŅŌŹĒ·¼ĻćĢž»ł | |
| C£® | ŌŚRCOOR”äÖŠ£¬µ±RŗĶR”ä¾łĪŖ-CH3Ź±£¬ÕāÖÖõ„½Š¼×Ėį¼×õ„ | |
| D£® | Ģ¼Ō×ÓŹżĻąĶ¬µÄ±„ŗĶŅ»ŌŖōČĖįŗĶ±„ŗĶŅ»ŌŖõ„»„ĪŖĶ¬·ÖŅģ¹¹Ģå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
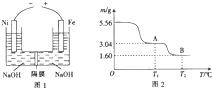 ĀĮ”¢Ģś¼°Ęä»ÆŗĻĪļŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓ¦ÓĆ£®
ĀĮ”¢Ģś¼°Ęä»ÆŗĻĪļŌŚ¹¤ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓ¦ÓĆ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē½āÖŹČÜŅŗÖŠ»ģČėĖ®£¬»įÓ°Ļģµē³Ų·“Ó¦ | |
| B£® | ·“Ó¦ÖŠ£¬SOCl2¼ČŹĒČܼĮ£¬ÓÖŹĒŃõ»Æ¼Į | |
| C£® | µē³Ų¹¤×÷¹ż³ĢÖŠ£¬ŃĒĮņõ£ĀČ£ØSOCl2£© ±»»¹ŌĪŖLi2SO3 | |
| D£® | µē³Ų¹¤×÷¹ż³ĢÖŠ£¬½šŹōļ®Ģį¹©µÄµē×ÓÓėÕż¼«ĒųĪö³öĮņĪļÖŹµÄĮæÖ®±ČĪŖ4£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«pH=4 CH3COOHČÜŅŗ¼ÓĖ®Ļ”ŹĶ10±¶£¬ČÜŅŗÖŠø÷Ąė×ÓÅØ¶Č¾ł¼õŠ” | |
| B£® | ÓĆ CH3COOHČÜŅŗµĪ¶ØµČĪļÖŹµÄĮæÅØ¶ČµÄNaOHČÜŅŗÖĮpH=7£¬V£ØCH3COOHČÜŅŗ£©£¼V£ØNaOHČÜŅŗ£© | |
| C£® | Ļņ0.2 mol/LµÄŃĪĖįČÜŅŗÖŠ¼ÓČėµČĢå»ż0.1 mol•L-1NH3•H2OČÜŅŗ£ŗc£ØCl-£©+c£ØOH-£©=c£ØH+£©+c£ØNH3•H2O£© | |
| D£® | ŌŚŗ¬0.1mol NaHSO4ČÜŅŗÖŠ£ŗc£ØH+£©=c£ØSO42-£©+c£ØOH-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬1.12L1H2ŗĶ0.2g 2H2¾łŗ¬ÓŠ0.1NAøöÖŹ×Ó | |
| B£® | ŌŚĶ¬Ń¹²»Ķ¬ĪĀµÄĒéæöĻĀ£¬ÖŹĮæĻąĶ¬µÄŃõĘųŗĶ³ōŃõĖłŗ¬ŃõŌ×ÓŹż²»ĻąĶ¬ | |
| C£® | ±ź×¼×“æöĻĀ£¬11.2LøżĶéĶźČ«Č¼ÉÕŗóÉś³ÉµÄCO2·Ö×ÓŹżĪŖ3.5NA | |
| D£® | ³£ĪĀĻĀ£¬½«5.6 g ĢśĶ¶Čė×ćĮæµÄÅØĮņĖįÖŠ×ŖŅʵē×ÓŹżĪŖ0.3 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
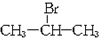 £»
£»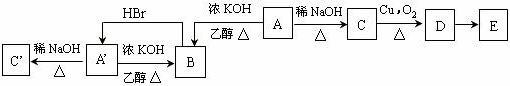
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 12.4 g°×Į×ÖŠŗ¬ÓŠ¹²¼Ū¼üŹżĪŖ0.4 NA | |
| B£® | 3Fe+4H2O£Øg£©=Fe3O4+4H2·“Ó¦ÖŠ£¬µ±5.6 g FeČ«²æ×Ŗ»ÆĪŖFe3O4Ź±£¬ŌņÓŠ0.3 NAµē×Ó·¢Éś×ŖŅĘ | |
| C£® | ŌŚ1 L 0.1 mol/LĢ¼ĖįÄĘČÜŅŗÖŠŅõĄė×Ó×ÜŹżµČÓŚ0.1 NA | |
| D£® | ŌŚ±ź×¼×“æöĻĀ£¬22.4 L CH4Óė18 g H2OĖłŗ¬ÓŠµÄµē×ÓŹż¾łĪŖ10 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | FeCl3ČÜŅŗÖŠ£ŗK£¬CH3OH£¬Br-£¬NO3- | |
| B£® | ŌŚ°±Ė®ČÜŅŗÖŠ£ŗAl3+£¬NO3-£¬Cl-£¬Ag+ | |
| C£® | ijĶøĆ÷³ĪĒåµÄČÜŅŗÖŠ£ŗNH4+£¬Fe3+£¬NO3-£¬Cl- | |
| D£® | ÄÜŹ¹¼×»ł³ČĻŌŗģÉ«µÄČÜŅŗ£ŗK+£¬Cr2O72-£¬CH2CH2OH£¬SO42- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com