
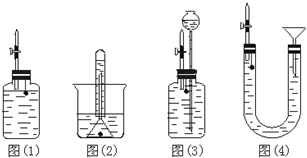
 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.分析 (1)随开随用随关随停的气体发生装置是利用固体和液体的接触或分离而实现的,其中固液分离可以是利用气压的增大把液体压入长颈漏斗等容器,达到固液分离的目的,从而使反应停止.
(2)根据极限法求出极限点,根据Mg和Al与盐酸的反应可知,当氢气的量固定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最小;
(3)根据溶液中的HCl、MgCl2、AlCl3与碱反应求出NaOH的物质的量;
(4)根据合金当中Al元素的质量与MgO中O元素的质量相等,求出Al质量分数.
解答 解:(1)图(1)当打开止水夹时固液接触,反应发生;当关闭止水夹时虽然广口瓶内的气压增大,但无法把液体和固体分离,故不能实现使反应随时发生随时停止的目的;
图(2)进行生成气体可以把液体排出试管,但不能使反应停止,不能实现使反应随时发生随时停止的目的;
图(3)当打开止水夹时固液接触,反应发生;当关闭止水夹时,随着气压的增大,把液体压入长颈漏斗,固体和液体分离反应停止,因此可以实现使反应随时发生随时停止的目的;
图(4)当打开止水夹时固液接触,反应发生;当关闭止水夹时,随着气压的增大,把液体压入U型管的左端,使固液分离,反应停止,因此可以实现使反应随时发生随时停止的目的;
故答案为:(3)(4);
(2)根据氢气体积,可以确定氢气物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应.根据Mg和Al与盐酸的反应可知,当氢气的量固定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最小
Mg~H2
0.15mol 0.15mol
2Al~3H2
0.1mol 0.15mol
所以两种状况下合金质量分别为:Mg:0.15mol×24g/mol=3.6g,Al:0.1mol×24g/mol=2.7g,
故答案为:2.7<a<3.6;
(3)根据反应过程我们可以发现
Mg~H2~2HCl~Mg2+~2NaOH~Mg(OH)2
Al~$\frac{3}{2}$H2~3HCl~Al3+~3NaOH~Al(OH)3
HCl(过量)~NaOH,故此不难发现,新引入的NaOH的物质的量与酸的物质的量相等,
由于沉淀当中只引入了OH-,故沉淀质量应为原合金质量a加上新引入的OH-的质量,而引入的OH-的物质的量为氢气物质的量的2倍,
所以沉淀的质量为:$\frac{3.36L}{22.4L/mol}$×2×17g/mol+ag=(a+5.1)g,
故答案为:(a+5.1);
(4)这一问我们依然需要通过宏观物质变化思考:易知最终物质为MgO,而最终MgO的质量与最初合金的质量相等,故可知合金当中Al元素的质量与MgO中O元素的质量相等,
所以合金当中Mg与Al的质量比即为MgO中Mg与O质量比相等,而MgO当中两元素质量比即为原子量之比,故合金当中Al质量分数为:w(Al)=$\frac{16}{16+24}$×100%=40%
故答案为:40%.
点评 本题考查了物质组成性质分析判断,主要是反应特征的理解应用,氧化还原反应电子转移,沉淀质量计算,物质含量测定方法,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ①>②>④>③>⑤ | D. | ①>②>③>⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②⑤ | C. | ②⑤ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阳极,其电极反应式:Cu2++2e-=Cu | |
| B. | 电解过程中,电解质溶液中c(Cu2+)不变 | |
| C. | 电解后,阴极上还附有极少量的Fe和Ni | |
| D. | 电解后,可用阳极泥来提炼金、银等贵金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com