
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,其中Na2O2不属于碱性氧化物 | |
| B. | SiO2是硅酸的酸酐,NO2是HNO3的酸酐 | |
| C. | Fe(OH)3与氢碘酸反应的类型为复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
分析 A.碱性氧化物是指能与酸反应生成盐和水的金属氧化物;
B.酸酐和对应的酸化合价要一样;
C.Fe(OH)3与氢碘酸反应发生氧化还原反应;
D.胶体和溶液中的分散质微粒能通过滤纸.
解答 解:A.因过氧化钠与酸反应生成盐、水和氧气,则过氧化钠不属于碱性氧化物,故A正确;
B.酸酐和对应的酸化合价要一样,N2O5是HNO3的酸酐,NO2中氮元素化合价为+4价不是酸酐,故B错误;
C.三价铁离子具有氧化性,能和还原性的碘离子之间发生氧化还原反应,生成碘单质和亚铁离子,不是复分解反应,故C错误;
D.将Fe(OH)3胶体和泥水分别进行过滤,分散质均能通过滤纸孔隙,故D错误,
故选A.
点评 本题涉及物质的分来以及物质的性质等方面知识的考查,注意知识的归纳和梳理是解题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 9.2mol/L | B. | 大于9.2mol/L | C. | 小于9.2mol/L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等 | |
| C. | 1 L一氧化碳的质量一定比1 L氧气质量小 | |
| D. | 等体积、等物质的量浓度的盐酸和硫酸中所含的H+数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{14}$C表示质子数为6、中子数为8的核素 | |
| B. | 甲醇(CH3OH)和甘油( 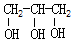 )互为同系物 )互为同系物 | |
| C. | C5H12的同分异构体有3种,其沸点各不相同 | |
| D. | CH3CH2CH2CH(CH3)2的名称是2-甲基戊烷' |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100ρ}{41}$ mol•L-1 | B. | $\frac{20}{ρ}$ mol•L-1 | C. | $\frac{50ρ}{41}$ mol•L-1 | D. | $\frac{25ρ}{41}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
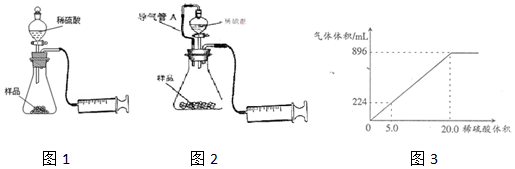
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:
现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com