
| A、乙醛 | B、丁醛 | C、戊醛 | D、已醛 |
| 26.2 |
| 0.5 |
| 26.2 |
| 0.5 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、这是一个置换反应 |
| B、该反应说明Cl2的还原性较I2的还原性弱 |
| C、该反应违背氧化还原反应的有关原理 |
| D、生成1 mol Cl2有10 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
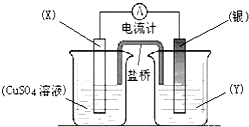
| A、电极X是正极,其电极反应为Cu-2e-=Cu2+ |
| B、银电极质量逐渐减小,Y溶液中c(Ag+)增大 |
| C、当X电极质量减少0.64g时,电解质溶液中有0.02mol电子转移 |
| D、外电路中电流计的指针有偏转 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com