
【题目】将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是 ( )

A. A点pH小于7是因为Cu2+水解使溶液显酸性
B. BC段阳极产物是Cl2
C. 整个过程中阳极先产生Cl2,后产生O2
D. CD段电解的物质是水
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】现有以下8种物质:①熔融状态的NaCl、②NO2、③NaHCO3、④铜、⑤AgCl、⑥酒精、⑦稀H2SO4、⑧FeCl3溶液。
(1)上述物质中,属于电解质的是_________,能导电的是_________。(填序号)
(2)写出③溶于水的电离方程式:_________。
(3)写出④与⑧反应的离子方程式:_________。
(4)标准状况下,3.36L②完全溶于水配成500mL溶液,获得溶液物质的量浓度为_________,此过程中转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物的摩尔质量为17g/mol;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.XZ2、M2Z2均为共价化合物
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是
Z(g)+W(s) △H>0,下列叙述正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大活化分子的百分数.有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Y、Z、W的原子半径由大到小顺序为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为____________。
(3)元素W位于周期表的第_____周期第________族,其非金属性比R弱,用原子结构的知识解释原因:__________。元素W和R的气态氢化物的稳定性关系为:________(写出化学式)。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:____________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素的原子序数为33,则:此元素原子的电子总数是______;有_____个不同运动状态的电子,有____个电子层,____个能级;简化的电子排布式为__________。
(2)1s22s22p63s23p违背了____________。核电荷数为24的元素,其价电子排布的轨道表示式______,其原子的最外层电子数和未成对电子数分别为_____和_____。
(3)电子排布式为1s22s22p63s23p6某微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________, 原子核外电子云有________种不同的伸展方向。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲进行0.1mol/L NaOH溶液与0.1mol/LHCl溶液的反应:
(1)写出NaOH溶液与HCl溶液反应的离子方程式___。
(2)要配制0.1mol/LNaOH溶液500mL,回答下列问题:
①需要称量NaOH固体___g;
②将NaOH固体用蒸馏水溶解后,未冷却直接转移至容量瓶,将导致所配制溶液浓度___。(填“偏大”、“偏小”或“无影响”)
③定容时,加蒸馏水至离刻度线下方1-2cm时,改用___继续滴加蒸馏水,使得溶液凹液面与刻度线相切。
(3)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸的物质的量浓度为___mol/L。
②欲用上述浓盐酸和蒸馏水配制0.1mol/L HCl溶液500mL,需用量筒量取___mL上述浓盐酸进行配制。
③实验室用稀盐酸溶解碳酸钙时,请写出对应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:

回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为__________________
(2)若丙池盛放足量的CuSO4溶液:①在丙池铁棒这极的现象是____________________。②在丙池中阳极的电极反应是_______________________________________。
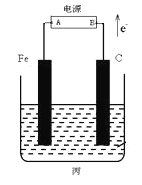
(3)若丙池中盛放滴加少量酚酞的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,___极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②标准状况下,当丙池中有0.1mol电子发生转移时切断电源,则理论上有____ L氯气生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com