
�뽫����5�����ʣ�N2O��FeSO4��Fe(NO3)3��HNO3��Fe2(SO4)3���ֱ����������Ӧ�ĺ����ϣ����һ����ѧ����ʽ����ƽ��
�ţ��� �� �� �� �� �� �� �� �� �� �� �� �� �� �� ��H2O
�ƣ���Ӧ���з���������Ӧ������ �� ������ԭ��Ԫ���� �� ��
�ǣ���Ӧ��1mol������ �� ����õ�����ʧȥ���� �� mol���ӡ�
�ȣ�HNO3��������Ӧ�б��ֳ����������� �� ������ѡ���ţ�
A������ B�������� C����ԭ�� D���Ȳ��ȶ���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ | �� | �� | �� |
| ��Ԫ��ԭ�Ӹ����� | n��A����n��C��=2��1 | n��A����n��C��=1��1 | n��B����n��A��=1��4 |
| ������ | �� | �� | �� |
| ��Ԫ��ԭ�Ӹ����� | n��D����n��B����n��C��=2��1��3 | n��E����n��F��=1��3 | n��B����n��F��=1��4 |
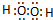
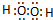


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
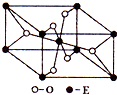 ��֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ��ǰ�����ڣ�Aλ�����ڱ���s������ԭ���е��Ӳ�����δ�ɶԵ�������ͬ��B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N�dz������л��ܼ���E�С����������֮�ƣ�E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��
��֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ��ǰ�����ڣ�Aλ�����ڱ���s������ԭ���е��Ӳ�����δ�ɶԵ�������ͬ��B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N�dz������л��ܼ���E�С����������֮�ƣ�E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ��У�߶����ϣ���ĩ��ѧ�Ծ���������ѧ�����һ�С�����һ�С��人���У��������棩 ���ͣ������
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com