
| A. | 2FeCl3+S2-═2FeCl2+S↓ | B. | 2FeCl3+H2S═2FeCl2+S↓+2H++2Cl- | ||
| C. | 2Fe3++S2-═2Fe2++S↓ | D. | 2Fe3++H2S═2Fe2++S↓+2H+ |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
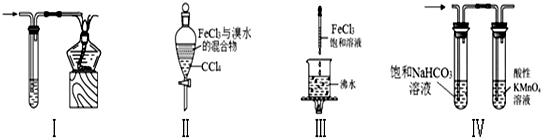
| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
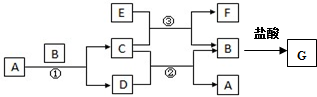
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | 在pH=2的溶液中:NH4+、K+、ClO-、Cl- | |
| C. | 在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、C1O-、NO3- | |
| D. | 水电离c(H+)=10-12的溶液中:Mg2+、Cu2+、SO42+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气凝结为液态的水 | B. | 氨气和氯化氢反应生成氯化铵晶体 | ||
| C. | 碳酸氢铵在常温情况下分解 | D. | CO点燃时生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
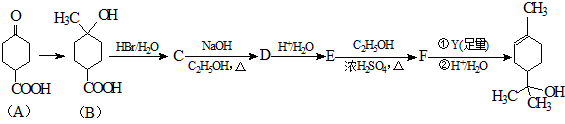
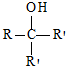
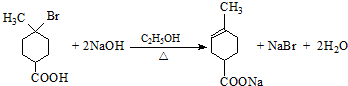 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com