
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应 |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析解答.
解答 解:A、甲烷和氯气混合光照一段时间后,甲烷中的氢原子被氯原子所代替生成氯代物,所以属于取代反应;乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应的结果,故A错误;
B、乙烯中的双键断裂,每个碳原子上结合一个溴原子生成1,2-二溴乙烯,所以属于加成反应;苯和氢气在一定条件下反应生成环己烷也是加成反应,故B错误;
C、在浓硫酸和加热条件下,苯环上的氢原子被硝基取代生成硝基苯,所以属于取代反应;在一定条件下,乙烯中的双键断裂,一个碳原子上结合一个氢原子,另一个碳原子上结合羟基,生成乙醇,该反应属于加成反应,故C正确;
D、苯能萃取溴水中的溴而使水层无色,不是加成反应是萃取;乙烯生成聚乙烯的反应属于加聚反应,故D错误,
故选C.
点评 本题考查了取代反应和加成反应的判断,难度不大,明确这两个概念的区别是解本题的关键.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )| 选项 | 操作与现象 | 解释与推论 |
| A | 电池放电时化学能转化为电能 | Zn(s)+Cu2+(aq)=Zn2++Cu(s)△H>0 |
| B | 该电池充电时铜棒变细 | 两电极区溶液颜色都变深 |
| C | 该电池放电时铜棒是电池正极 | Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D | 该电池充电时a接电源正极 | 电极反应Cu2++2e-=Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 | |
| B. | 等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 | |
| C. | 等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 | |
| D. | 等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
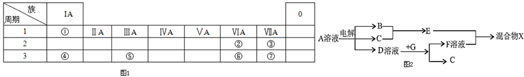
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )
已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )| A. | ①可能为CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | B. | ①可能为Fe+2Fe3+═3Fe2+ | ||
| C. | ②可能为2NO+O2═2NO2 | D. | ②可能为CO32-+H2O+CO2═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于胶体,可发生丁达尔效应 | |
| B. | 所得的分散系中,分散质的主要成分为FeO | |
| C. | 该分散系进行电泳实验时,阳极周围黑色加深 | |
| D. | 往油酸钠水溶液中滴加浓溴水振荡,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | 升高温度,不影响活化分子百分数 | |
| C. | 使用催化剂使该反应的反应热发生改变 | |
| D. | E1-E2=△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c | |
| B. | 常温下5.0×10-3mol/LKHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(OH)2(s)?M2+(aq)+2OH-(aq)Ksp=a; 当含M(OH)2固体的悬浊液中 c(M2+)=b mol/L时,溶液的pH等于14+$\frac{1}{2}1g(\frac{b}{a})$ | |
| D. | 图中a点溶液中各离子浓度的关系是: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com