
分析 (1)根据钠原子守恒计算出的物质的量,再S原子守恒计算出SO2的物质的量,根据方程式计算Cu的物质的量和质量;
(2)根据方程式计算参加反应的硫酸,再根据溶液中氢离子浓度计算出未反应的硫酸,然后计算浓硫酸的浓度.
解答 解:(1)SO2气体用50mL 1.2mol•L-1 NaOH溶液吸收,得到的NaHSO3和Na2SO3的混合液中,两种溶质的物质的量恰好相等,设各为xmol,
则n(Na)=2x+x=3x=0.05L×1.2mol/L=0.06mol,所以x=0.02mol,
S原子守恒可知,n(SO2)=0.02mol+0.02mol=0.04mol;
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,则n(Cu)=n(SO2)=0.04mol,则m(Cu)=0.04mol×64g/mol=2.56g;
故答案为:2.56;
(2)根据方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,参加反应的n(H2SO4)=2n(SO2)=0.04mol×2=0.08mol,
溶液中剩余的硫酸为n(H2SO4)=$\frac{1}{2}$×n(H+)=$\frac{1}{2}$×0.2L×0.1mol/L=0.01mol,
所以浓硫酸物质的量浓度为c=$\frac{n}{V}$=$\frac{0.08mol+0.01mol}{0.005L}$=18mol/L;
故答案为:18.
点评 本题考查化学方程式的计算,根据题给信息确定气体成分是解本题关键,会利用守恒思想解答问题,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫铝是纯净物 | |
| B. | 泡沫铝是一种合金 | |
| C. | 泡沫铝是一种优质的建筑材料和轻质材料 | |
| D. | 泡沫铝可用于飞机制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
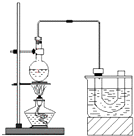 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素中,金属活泼性最强的是Li | |
| B. | 第三周期元素中,原子半径最大的是Cl | |
| C. | 短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,属于取代反应;
,属于取代反应;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com