
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
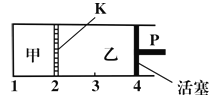
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列“解释或结论”与“实验操作及现象”不相符的一组是
序号 | 实验操作及现象 | 解释或结论 |
A | 浓硫酸滴到纸张上,纸变黑 | 浓硫酸有脱水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和 漂白性物质 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定有CO32- |
D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。
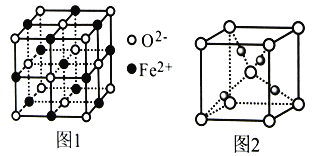
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 11 月《Science》杂志报道了王浩天教授团队发明的制取H2O2 的绿色方法,原理如图所示(已知:H2O2 ![]() H+ + H2O , Ka = 2. 4×10一12 )下列说法不正确的是
H+ + H2O , Ka = 2. 4×10一12 )下列说法不正确的是
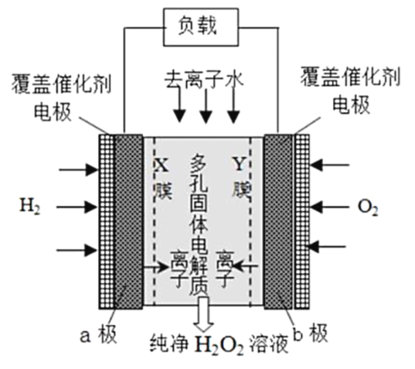
A.b 极上的电极反应为O2 +H2O +2e- =HO2 - +OH
B.X 膜为选择性阳离子交换膜
C.催化剂可促进反应中电子的转移,加快反应速率
D.每生成1 mol H2O2 电极上流过4 mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______(填写序号);
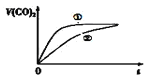
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示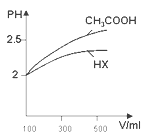 ,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太和一中理化创新社的同学们为了探究在实验室制备![]() 的过程中有水蒸气和
的过程中有水蒸气和![]() 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
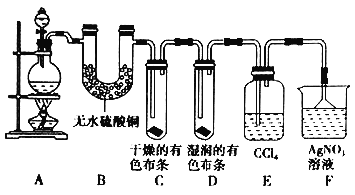
(1)若用含有![]() 的浓盐酸与足量的
的浓盐酸与足量的![]() 反应制
反应制![]() ,制得的
,制得的![]() 体积(标准状况下)总是小于
体积(标准状况下)总是小于![]() 的原因是_____________________。
的原因是_____________________。
(2)①装置B的作用是_______________________,现象是_____________________。
②装置C和D出现的不同现象说明的问题是__________________________。
③装置E的作用是_______________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入![]() 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入![]() 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入___________________________。
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:A(g)+3B(g)![]() 2C(g),有关下列图像说法的不正确的是( )
2C(g),有关下列图像说法的不正确的是( )

A. 依据图A可判断正反应为放热反应
B. 在图B中,虚线可表示使用了催化剂
C. 若正反应的△H<0,图C可表示升高温度使平衡向逆反应方向移动
D. 由图D中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了对锂离子电池方面的研究作出贡献的约翰·B·古迪纳夫(John B.Goodenough)等三位科学家。已知可充电镍酸锂离子电池的工作原理如图所示,其总反应为:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
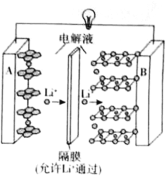
A.放电时,A电极为![]() 作原电池负极
作原电池负极
B.放电时,B电极反应式为![]()
C.充电时,A电极反应式为![]()
D.充电时,当电路中通过![]() 电子的电量时,A、B两极质量变化差为
电子的电量时,A、B两极质量变化差为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com