
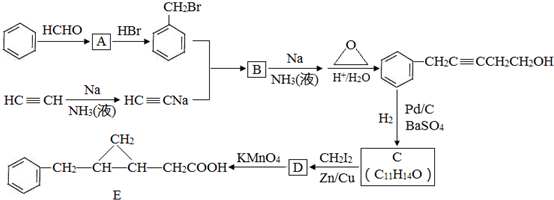
 ,反应类型是取代反应.
,反应类型是取代反应.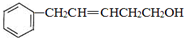 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个.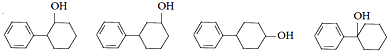 任意2种.
任意2种. .
. 分析 苯与甲醛发生加成反应生成A为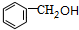 ,A与HBr发生取代反应生成
,A与HBr发生取代反应生成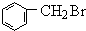 ,
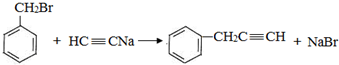
,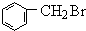 与HC≡CNa发生取代反应生成B为
与HC≡CNa发生取代反应生成B为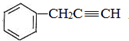 .
.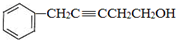 与氢气发生加成反应生成C,结合C的分子式可知C为
与氢气发生加成反应生成C,结合C的分子式可知C为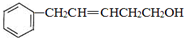 ,结合E的结构可知C与CH2I2反应生成D为
,结合E的结构可知C与CH2I2反应生成D为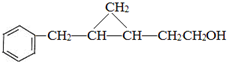 ,D发生氧化反应生成E.
,D发生氧化反应生成E.
解答 解:苯与甲醛发生加成反应生成A为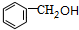 ,A与HBr发生取代反应生成
,A与HBr发生取代反应生成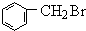 ,
,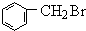 与HC≡CNa发生取代反应生成B为
与HC≡CNa发生取代反应生成B为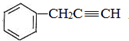 .
.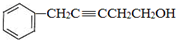 与氢气发生加成反应生成C,结合C的分子式可知C为
与氢气发生加成反应生成C,结合C的分子式可知C为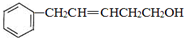 ,结合E的结构可知C与CH2I2反应生成D为
,结合E的结构可知C与CH2I2反应生成D为 ,D发生氧化反应生成E.
,D发生氧化反应生成E.
(1)a.苯和乙炔都能使溴水褪色,前者为萃取,属于物理变化,后者发生加成反应,为化学变化,故a错误;
b.苯和乙炔的最简式相同,含碳量高,在空气中燃烧都有浓烟产生,故b正确;
c.苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯,需要浓硫酸作催化剂,故c错误;
d.聚乙炔是一种有导电特性的高分子化合物,故d正确,
故选:bd;
(2)A为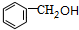 ,名称为苯甲醇,故答案为:苯甲醇;
,名称为苯甲醇,故答案为:苯甲醇;
(3)生成B的化学方程式为: ,属于取代反应,
,属于取代反应,
故答案为: ;取代反应;
;取代反应;
(4)C的结构简式为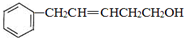 ,苯环连接2原子处于同一平面,碳碳双键连接的原子处于同一平面,旋转碳碳单键可以使羟基连接的碳原子处于碳碳双键平面内,由苯环与碳碳双键之间碳原子连接原子、基团形成四面体结构,两个平面不能共面,最多有7个碳原子都可以共平面,
,苯环连接2原子处于同一平面,碳碳双键连接的原子处于同一平面,旋转碳碳单键可以使羟基连接的碳原子处于碳碳双键平面内,由苯环与碳碳双键之间碳原子连接原子、基团形成四面体结构,两个平面不能共面,最多有7个碳原子都可以共平面,
故答案为: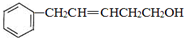 ;7;
;7;
(5)与D( )同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有:
)同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有: ,
,
故答案为:4; 任意2种;
任意2种;
(6)以乙炔和必要试剂合成环丙烷的路线: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,注意根据转化中有机物的结构、反应条件等进行推断,熟练掌握官能团的性质与转化,较好地考查学生自学能力、分析推理能力与知识迁移运用能力.


科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液 | B. | c(H+)>c(OH-) 的溶液 | ||
| C. | c(H+)=1×10-7mol•L-1 | D. | c(H+)=c(OH-) 的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 氢键也是一种化学键 | D. | 离子化合物中一定含有金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用如图所示装置除去Cl2中含有的少量HCl | |
| B. |  如图所示为石油分馏 | |
| C. |  如图所示为检查装置气密性 | |
| D. | 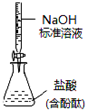 如图所示为测定未知盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| B. | 由H2O2制得2.24 L O2,转移的电子数目为0.4 NA | |
| C. | 常温常压下,8 g O2与O3的混合气体中含有4 NA个电子 | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
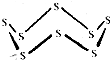 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com