
 如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子. ;
;分析 依据无机框图题,关键是找准突破点.X为无色液体,则X应该是水,所以Y是氧气,B是氢氧化钠.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,说明H应该是SO2.SO2具有还原性,被过氧化钠氧化生成硫酸钠,硫酸钠和钡离子反应生成硫酸钡白色沉淀.SO2被氧气氧化生成三氧化硫,三氧化硫溶于水生成硫酸,即I是三氧化硫,K是硫酸.一个D分子中含有10个电子,所以D可能是氨气,则E是NO,F是NO2,所以G是硝酸.A是由短周期元素组成的酸式盐,所以A是亚硫酸氢铵,所以B是氢氧化钠,C是亚硫酸钠,依据判断分析回答问题.
解答 解:(1)分析可知D为氨气,电子式为: ,
,
故答案为: ;
;
(2)分析可知,D+H+X→A的反应是氨气和二氧化硫和水反应生成亚硫酸氢铵的反应,化学方程式为:NH3+SO2+H2O═NH4HSO3;
故答案为:NH3+SO2+H2O═NH4HSO3
(3)C→H是亚硫酸钠和连锁反应是二氧化硫、水和硫酸钠,反应的离子方程式为:SO32-+2H+═SO2↑+H2O;
故答案为:SO32-+2H+═SO2↑+H2O;
(4)D与K反应生成的正盐是氨气和硫酸反应生成的硫酸铵,化学式为:(NH4)2SO4;
故答案为:(NH4)2SO4;
(5)1mol H(g)为SO2 ,完全转化为I(g)为SO3时放热98.3kJ,2mol二氧化硫全部转化放热196.6KJ;
反应的热化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ•mol-1;
某条件下,当加入4mol H为SO2 和2mol Y为O2后,放出314.56kJ的热时,依据热化学方程式计算消耗二氧化硫的物质的量,设为x:
2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ•mol-1
2mol 196.6KJ
x 314.56KJ
x=3.2mol,转化率=$\frac{3.2mol}{4mol}$×100%=80%;
故答案为:2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ•mol-1;80%;
(6)一定温度下,在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了$\frac{1}{18}$.依据化学平衡三段式列式计算:反应为4NH3+5O2=4NO+6H2O,设生成一氧化氮物质的量为X
有可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
起始量(mol) 4 5 0 0
变化量(mol) X $\frac{5}{4}$X X $\frac{6}{4}$X
平衡量(mol) 4-X 5-$\frac{5}{4}$X X $\frac{6}{4}$X
测得平衡时容器内的压强比反应前增加了$\frac{1}{18}$,相同条件下,压强之比等于物质的量之比,4-X+5-$\frac{5}{4}$X+X+$\frac{6}{4}$X=5+4+(5+4)$\frac{1}{18}$X=2mol,
则前2min内用E表示的平均反应速率=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/L•min;
平衡时D为NH3的浓度=$\frac{4mol-2mol}{2L}$1mol/L;
故答案为:0.5;1.
点评 本题考查了物质转化关系的分析判断,转化关系和物质性质、反应现象的理解,找到推断的突破口是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
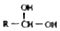 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$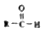 请根据如图回答:
请根据如图回答: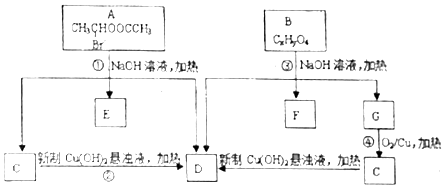
 .
. ;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.
;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.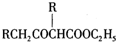 +C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com